
ij��Һ���ܺ���Cl����SO42����CO32����NH4+��Fe3+��Al3+��K+�е����ֻ���֣�ȡ����Һ100mL���������NaOH��Һ�����ȣ��õ�448mL����������壬ͬʱ�������ɫ�����������ˡ�ϴ�ӡ����գ��õ�1.6g���壻��������Һƽ���ֳ����ݣ�һ���м�����BaCl2��Һ���õ�2.33g����������ij�������һ����ͨ�����CO2�õ�1.56g��ɫ�������ɴ˿��ƶ�ԭ��Һһ�����е��������༰��Ũ�ȣ�����������±����ɲ���������
һ�����е��������� ���� ���� ����
���ʵ���Ũ�ȣ�mol/L�� ���� ���� �� ���� ���ݡ�
���㣺 �������ӵļ��鷽����
ר�⣺ ���ʼ�������⣮
������ �������NaOH��Һ�����ȣ��õ�0.02mol���壬��֪һ������笠����ӣ�
���ɫ����������������1.6g����Ϊ��������������֪һ����Fe3+��һ��û��CO32����
2.33g����������ij�����Ϊ���ᱵ���������ʵ���Ϊ��0.01mol��ԭ��Һ�к���0.02mol��������ӣ�
��һ����ͨ�����CO2�õ�1.56g��ɫ��������ɫ����Ϊ����������ԭ��Һ��һ�����������ӣ����ʵ���Ϊ0.02mol��ԭ��Һ�е������ӵ����ʵ���Ϊ0.04mol��
����������������������ӣ����ݵ���غ����������ӵĴ��ڼ����ݣ�
��� �⣺����NaOH��Һ����������ͺ��ɫ����������Ϊ���������ɫ����Ϊ��������������Һ��һ������NH4+��Fe3+���������ӹ����֪����CO32������BaCl2��Һ���ɲ���������ij�����֪��Һ�к�SO42������һ����ͨ�����CO2�õ�1.56g��ɫ�������ð�ɫ����Ϊ������������ԭ��Һ��һ������Al3+��
n��NH3��=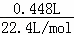 =0.02mol����n��NH4+��=0.02mol��笠�����Ũ��Ϊ��c��NH4+��=
=0.02mol����n��NH4+��=0.02mol��笠�����Ũ��Ϊ��c��NH4+��=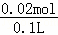 =0.2mol/L��
=0.2mol/L��
n��Fe2O3��=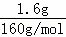 =0.01mol����n��Fe3+��=2n��Fe2O3��=0.02mol��c��Fe3+��=
=0.01mol����n��Fe3+��=2n��Fe2O3��=0.02mol��c��Fe3+��=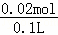 =0.2mol��
=0.2mol��
n��BaSO4��=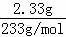 =0.01mol����n��SO42����=0.01mol����ԭ��Һ�к�����������ӵ����ʵ���Ϊ0.02mol��c��SO42����=
=0.01mol����n��SO42����=0.01mol����ԭ��Һ�к�����������ӵ����ʵ���Ϊ0.02mol��c��SO42����=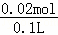 =0.2mol/L��
=0.2mol/L��
n��Al3+��=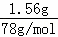 =0.02mol��ԭ��Һ�д��������ӵ����ʵ���Ϊ0.04mol��c��Al3+��=
=0.02mol��ԭ��Һ�д��������ӵ����ʵ���Ϊ0.04mol��c��Al3+��=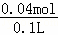 =0.4mol/L��
=0.4mol/L��
��Һ��NH4+��Al3+��Fe3+��������ɵ����ʵ���Ϊ��0.02mol+3��0.02mol+0.04mol��3=0.20mol��SO42�����������Ϊ2��0.02mol=0.04mol��
�ݵ���غ㣬����Һ�б�Ȼ����������һ��������Cl�������ڼ�������ȷ���Ƿ���ڣ����������ӵ����ʵ���һ����С�ڣ�2mol��0.04mol=0.16mol��c��Cl������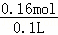 =1.6mol/L��
=1.6mol/L��
�ʴ�Ϊ��
һ�����е��������� SO42�� NH4+ Fe3+ Al3+ Cl��
���ʵ���Ũ�ȣ�mol/L�� 0.2 0.2 0.2 0.4 ��1.6
������ ���⿼���˳������ӵļ��飬���ʵ���Ũ�ȵļ��㣬��Ŀ�Ѷ��еȣ�ע�����ճ������ӵ����ʼ����鷽������������������Ӻ������ӵ����ʵ����ļ���Ϊ�״��㣬ע����������Ϊ�ֳ����ȷݵ������
��


 ��Уͨ��֤��Ч��ҵϵ�д�
��Уͨ��֤��Ч��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʽΪC4H8Cl2���ҷ����к�����������ͬ���칹�干�У������������칹����������
| �� | A�� | 2�� | B�� | 3�� | C�� | 4�� | D�� | 5�� |
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����Ҷ�����C2H6O2������ᣨCH3COOH����ɵĻ������������Ԫ�ص���������Ϊ9%������������Ԫ�ص���������Ϊ��������
�� A�� 52% B�� 37% C�� 16% D�� ��ȷ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��Һ����Fe2+��Na+��Al3+��Ba2+��SO42����NO3����Cl���е�4�����ӣ��������ӵ����ʵ�����Ϊ1mol���������Һ�м��������ϡ���ᣬ�����ݲ���������Һ������������䣨������ˮ�ĵ�������ӵ�ˮ�⣩������˵������ȷ���ǣ�������
�� A�� �������Һ�м��������ϡ�����KSCN��Һ����Һ��Ѫ��ɫ
�� B�� �������Һ�м��������ϡ���ᣬ�����������������ܱ�ɺ���ɫ
�� C�� ����Һ�������������ǣ�Fe2+��Na+��SO42����NO3��
�� D�� �������Һ�м���������NaOH��Һ����ַ�Ӧ���ˡ�ϴ�ӡ����գ��������ù��������Ϊ72g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��ɫ��Һ��ֻ��������NH4+��K+��Al3+��Mg2+��HCO3����Cl����I����MnO4����SO42���������еļ������ӣ�Ϊ��������ɣ��ֽ�������ʵ�飺
��ȡ10mL����Һ���Թ��еμ�������Ba��N03��2��Һ����ϡ�����ữ����˵õ�0.03mol��ɫ�����ף�
��ȡ������Ӧ�����Һ������AgN03��Һδ������������
����ȡ10mL����Һ���Թ��У��μ�NaOH��Һ������ɫ�����ң�������NaOH�����ʵ���Ϊ0.03molʱ�����������ﵽ������μ�NaOH��Һ�����ȣ���ʼ������������ռ���������������ɱ����Ϊ0.224L�������ȫ���ݳ�������������ȫ�ܽ⣮
�����ƶ���ȷ���ǣ�������
�� A�� �϶���Na+��Mg2+��Al3+��Cl�� B�� �϶���Al3+��SO42����NH4+
�� C�� �϶�û��K+��HCO3����MnO4�� D�� �϶�û��K+��NH4+��Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijǿ������ҺX�н�����Ba2+��Al3+��NH4+��Fe2+��Fe3+��CO32����SO32����SO42����Cl����NO3���е�һ�ֻ��֣�ȡ����Һ��������ʵ�飬ʵ��������£�
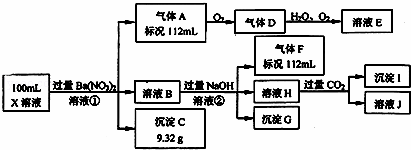
����������Ϣ���ش��������⣺
��1����������������ʵ�鲻��ȷ����ҺX���Ƿ��е����������ӷֱ�����
�����ӷ��̱������з�Ӧ��
������������A��������
����������ҺH��������
��3��������������������Ũ��Ϊ2mol/L��������l0mlʱ��ʼ����������55mlʱ���������ﵽ���ֵ0.03mol�������μӳ����������ֲ��䣬����ٵμӳ��������ܽ⣬��60mlʱ����������Ϊ0.025mol�ұ��ֲ��䣬��ԭ��Һ��c��Fe2+��Ϊ����mol/L��c��Fe3+��Ϊ����mol/L��c��Cl����Ϊ����mol/L��������Щ���Ӳ����ڣ�����0mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ݱ�������300�桢70MPa���ɶ�����̼�������ϳ��Ҵ��ѳ�Ϊ��ʵ��2CO2��g��+6H2��g�� CH3CH2OH��g��+3H2O��g�� ��������������ǣ���
CH3CH2OH��g��+3H2O��g�� ��������������ǣ���
 A�� ʹ��Cu﹣Zn﹣Fe�����ɴ���������Ч��
A�� ʹ��Cu﹣Zn﹣Fe�����ɴ���������Ч��
B�� ��Ӧ����300����п��Ʋ�÷�Ӧ�����ȷ�Ӧ
C�� �������CO2��������H2��ת����
D�� ��ƽ���������з����CH3CH2OH��H2O�����CO2��H2��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���л���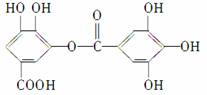 ����������ȷ����(����)
����������ȷ����(����)
A�������£�����Na2CO3��Һ��Ӧ�ų�CO2
B���ܷ�������ˮ�⣬1 mol���л���������8 mol NaOH
C����ϡH2SO4�������������л���
D�����л���ķ���ʽΪC14H10O9
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����Ȼ����У������ɽ���������ֱ�ӷ�Ӧ�Ƶã������ɽ��������ᷴӦ�Ƶõ���( )
A��CuCl2 B��FeCl2 C��FeCl3 D��AlCl3
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com