
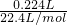 =0.01mol,
=0.01mol,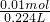 =0.045mol/L,
=0.045mol/L,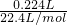 =0.01mol,
=0.01mol, 2HCl+O2↑
2HCl+O2↑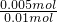 =112mL,
=112mL,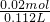 =
=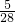 mol/L,
mol/L,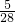 mol/L.
mol/L.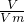 计算溶质的物质的量,装有224mLHCl气体的烧瓶倒置在水中,水逐渐上升充满整个烧瓶,则溶液的体积为224mL,利用c=
计算溶质的物质的量,装有224mLHCl气体的烧瓶倒置在水中,水逐渐上升充满整个烧瓶,则溶液的体积为224mL,利用c= 来计算浓度;对于Cl2溶于水时较复杂,根据Cl2+H2O═HCl+HClO、2HClO
来计算浓度;对于Cl2溶于水时较复杂,根据Cl2+H2O═HCl+HClO、2HClO 2HCl+O2↑及溶质为HCl来计算即可.
2HCl+O2↑及溶质为HCl来计算即可.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省杭州高级中学高一(上)期中化学试卷(实验班)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com