
【题目】下列描述中,不正确的是
A.FeSO4 可用于防止食品氧化变质,延长食品的保质期
B.向Fe2(SO4)3 溶液中加入一定量的铜粉,铜粉全部反应后,溶液中一定含有Fe2+
C.物质NaHCO3、Al2O3、Fe2O3、Al(OH)3、Al 都既能跟盐酸反应, 又能跟氢氧化钠溶液反应
D.铁在氧气中燃烧,生成黑色的Fe3O4
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素。A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如表所示:
化合物 | 甲 | 乙 | 丙 | 丁 |
化学式 | A2C | A2C2 | D2C2 | D2E |
回答下列问题:
(1)指出元素F在周期表中的位置__________________。
(2)化合物乙的电子式为_____________,用电子式表示形成化合物丁的过程_____ 。
(3)写出丙与甲反应的离子方程式:___________________。
(4)固体氧化物燃料电池是以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许O2–在其间通过,该电池的工作原理如图所示,其中多孔Pt电极a、b分别是气体C2、A2的载体。该电池的负极为____(填a或b);O2–流向____极(填“正”或“负”);该电池的正极反应式为 _____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g·L-1)如右图所示。下列叙述正确的是

A.盐酸浓度越大,Ksp(PbCl2)越大
B.PbCl2能与一定浓度的盐酸反应
C.x、y两点对应的溶液中c(Pb2+)相等
D.往含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修物质结构与性质]
铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3。
请回答下列问题:
(1)C、N、O的电负性由大到小的顺序为 ,基态Fe原子的价电子排布式为 。
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是 ,Fe(CO)5在空气中燃烧后剩余固体呈红棕色,其化学方程式为 。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是 ,配体中提供孤对电子的原子是 。
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有 形成。
a.离子键 b.配位键 c.非极性键 d.б键
(5)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为 ,面心立方堆积与体心立方堆积的两种铁晶体的密度之比为 (写出已化简的比例式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的数值。下列说法不正确的是
A.0.05 mol液态KHSO4中含有0.05 NA个阳离子
B.氢氧燃料电池正极消耗22.4 L气体时,电路中通过电子的数目为4 NA
C.常温下,100 mL 1 molL-l盐酸与4.6 g钠反应生成H2分子数目为0.1NA
D.在电解精炼粗铜的过程中,当阴极析出32 g铜时转移电子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请同答下列问题:
(1)元素W在周期表中的位置是________,XR2的电子式为____。
(2)单质X和元素Y的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为___________。Y、W的氢化物沸点高的是_______(写化学式),原因是___________________。
(3)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香柠檬油是从香柠檬树的果皮中提炼的橘子味的香油,33%的女用香水用到了这种原料。香柠檬油含微量的香柠檬酚和香柠檬醚,其结构如右图。下列说法正确的是

A. 香柠檬醚的分子式为C13H6O4
B. 香柠檬酚可与甲酸反应转化成香柠檬醚
C. 1 mol香柠檬酚最多可与2 mol Br2发生反应
D. 1 mol香柠檬酚最多可以与3 mol NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将海水淡化与浓缩海水资源化结合起来是综合利用海水的重要途径之一。浓缩海水中的Br-、Mg2+可通过一系列工艺流程提取出来。
(1)如图是采用膜分离技术淡化海水的示意图,淡化膜可让水分子通过,而海水中其他离子不能通过。加压后,左侧海水中增加的是 (填字母)
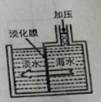
A.溶质质量
B.溶剂质量
C.溶质的质量分数
(2)在浓缩海水中通入氯气,生成Br2,有关的离子方程式是________ _____,该反应中的氧化剂是_____________,生成的Br2可用热空气法吹出的原因_____________。
(3)从海水中提取镁的主要步骤如下:

①操作a是
②试剂X是 ,A与X反应的离子方程式 。
③为检验MgCl2溶液中是否含有NaCl残留,实验操作是 。
④生产出的镁在运输途中应防雨淋,原因是 (用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中可能大量共存的是
A.弱碱性溶液中:Na+、K+、Cl-、HCO3-;
B.“84”消毒液中:SiO32-、CO32-、Na+、S2-
C.使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
D.0.1mol·L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com