
| A. | ①④ | B. | ③④ | C. | ①③ | D. | ①③④ |
分析 反应中C为固体,增加固体的量对反应速率没有影响,改变体积或压强,只有反应反应物质的浓度发生变化时,反应速率才发生改变,以此解答该题.
解答 解:①增加C的量,物质的浓度不变,反应速率不变,故正确;
②将容器体积缩小一半,气体浓度增大,反应速率增大,故错误;
③保持体积不变,充入N2使体系压强增大,但参加反应的物质的浓度不变,反应速率不变,故正确;
④保持压强不变,充入N2使体系体积增大,参加反应的气体的浓度减小,反应速率减小,故错误.
故选:C.
点评 本题考查化学反应速率的因素,为高考高频考点,侧重于学生的分析能力和基础知识的考查,有利于化学科学素养的培养和提高学生学习的积极性,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 上述反应属于分解反应、氧化还原反应 | |
| B. | 高氯酸铵属于盐,该反应属于离子反应 | |
| C. | 上述反应瞬间产生的高温气体是推动飞船飞行的主要因素 | |
| D. | 在反应中NH4ClO4既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
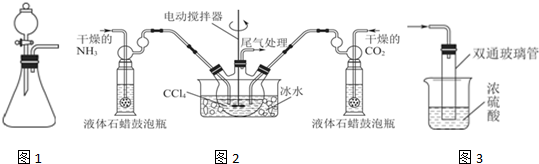
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H++SO42-+Ba2++OH-→BaSO4↓+H2O | |
| B. | 2H++SO42-+Ba2++2OH-→BaSO4↓+2H2O | |
| C. | Mg2++H++2SO42-+2Ba2++3OH-→Mg(OH)2↓+2BaSO4↓+H2O | |
| D. | Mg2++2H++2SO42-+2Ba2++4OH-→Mg(OH)2↓+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加入过量氨水 Al3++3OH-═Al(OH)3↓ | |
| B. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2═Fe3++2H2O | |
| C. | 碳酸钙与醋酸反应 CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 电解饱和食盐水 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+C12↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:1 | C. | 2.5×104:2 | D. | 2.5×104:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHS溶液显碱性:HS-+H2O?H3O++S2- | |
| B. | 明矾净水:Al3++3H2O?Al(OH)3(胶体)+3H+ | |
| C. | 制备TiO2纳米粉:TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4HCl | |
| D. | 醋酸使碳酸钙溶解:CaCO3+2CH3COOH═Ca 2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L0.1mol/L的NaHCO3溶液中含CO32-数目为0.1NA | |
| B. | 含2.3g Na+的Na2O和Na2O2的混合物中,阴离子总数等于0.05 NA | |
| C. | 2.7g铝投入到一定量的稀盐酸中,一定产生0.15NA个H2 | |
| D. | Fe在足量Cl2中燃烧,转移电子数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com