
【题目】某工厂用提取粗盐后的盐卤(主要成分为NaCl)制备金属镁,其工艺流程如下,下列说法中,错误的是
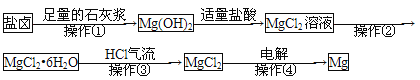
A. 若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器
B. 操作②是蒸发浓缩、降温结晶过滤、洗涤等步骤
C. 操作③通入HCl气流是为了抑制MgCl2的水解
D. 在整个制备过程中,未发生置换反应
【答案】A
【解析】A项,盐卤中加入足量的石灰浆,盐卤中的Mg2+完全转化为Mg(OH)2沉淀,用过滤法进行分离,需要的主要玻璃仪器有:烧杯、漏斗、玻璃棒,错误;B项,从MgCl2溶液中获得MgCl2·6H2O的操作是:蒸发浓缩、降温结晶、过滤、洗涤,正确;C项,若直接加热MgCl2·6H2O,MgCl2水解生成Mg(OH)2和HCl,加热由于HCl的挥发促进MgCl2的水解,最终不能获得无水MgCl2,为了抑制MgCl2的水解在HCl气流中加热,正确;D项,盐卤中加入足量石灰浆、Mg(OH)2与盐酸的反应都为复分解反应,MgCl2·6H2O→MgCl2以及MgCl2→Mg为分解反应,整个制备过程未发生置换反应,正确;答案选A。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
(1)SO2(g)+2CO(g)2CO2(g)+S(l)△H<0
①如果要提高上述反应的反应速率,可以采取的措施是 . (选填编号)
a.减压 b.增加SO2的浓度 c.升温 d.及时移走产物
②若反应在恒容的密闭绝热容器中进行,下列说法不正确的是 . (选填编号)
a.平衡前,随着反应的进行,容器内压强始终不变
b.当容器内温度不再变化时,反应达到了平衡
c.其他条件不变,升高温度可增大平衡常数
d.其他条件不变,使用不同催化剂,该反应热效应不同
③该反应的平衡常数表达式是′;某温度下2L恒定容器中加入2mol的SO2和2mol的CO.10分钟内,气体密度减小了8g/L,则CO的反应速率是 .
(2)SO2(g)+NO2(g)NO(g)+SO3(g)
①在2L恒定容器中加入2mol的SO2和2mol的NO2 , 达到平衡时测得SO2的转化率为50%,向该容器中再加入1mol的SO2 , 平衡将向方向移动,计算重新达到平衡时SO2的浓度是 , SO2的转化率由50%变为 , NO2的转化率由变为 .
②实验结果启示我们:增大一种反应物浓度,其转化率将(填增大、减小或不变),另一种反应物的转化率将 . 现实生产的意义是:可以通过增大的用量,来提高成本高的反应物的利用率.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个2L的密闭容器中,发生反应2SO3(g)2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示: 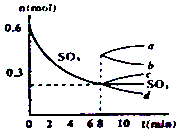
(1)用O2表示0~8min内该反应的平均速率v= .
(2)升高温度,K值将;容器中气体的平均相对分子质量将 . (填“增大”“减小”或“不变”)
(3)能说明该反应已达到平衡状态的是
a.v(SO3)=2v(O2) b.容器内压强保持不变
c.v逆(SO2)=2v正(O2) d.容器内密度保持不变
(4)从8min起,压缩容器为1L,则SO3的变化曲线为
A.a
B.b
C.c
D.d.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中△H的数值表示可燃物燃烧热的是( )
A.CO(g)+ ![]() O2(g)═CO2(g)△H=﹣283 kJmol﹣1
O2(g)═CO2(g)△H=﹣283 kJmol﹣1
B.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣802.3 kJmol﹣1
C.2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJmol﹣1
D.H2(g)+Cl2(g)═2HCl(g)△H=﹣184.6 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A. 在氨水中加入少量的水或氯化铵固体后,都能使溶液中的c(NH4+) 减小
B. 相同体积、pH均为3的HA和HB两种酸分别与足量的锌充分反应,HA放出的氢气多,说明HB 的酸性比HA 的酸性强
C. 工业电解食盐水中,电解池被阳离子交换膜隔成阴极室和阳极室,目的是避免阳极产生的气体与烧碱反应
D. 在等浓度的NaCl 和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl 沉淀,则Ksp(AgCl)![]() Ksp(Ag2CrO4)
Ksp(Ag2CrO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A.工业上以二氧化锰和浓盐酸为原料制取氯气
B.溴化银可用于人工降雨、氯气可用于制备药物
C.工业上常用 H2和 Cl2直接化合的方法生产氯化氢以制得盐酸
D.碘称为“海洋元素”,从海产品中提取碘是工业获取碘的重要途径
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如图(废料中含有Al、Li、Co2O3和Fe2O3等物质)。

已知:物质溶解性:LiF难溶于水,Li2CO3微溶于水
请回答:
(1)Ⅰ中发生反应的化学方程式为______________________。如是氧化还原反应,在方程式中用单线桥标记电子转移:_________________________。如不是此步略。
(2)写出步骤Ⅰ中Co2O3与盐酸反应生成Cl2的离子方程式:_____________________。
(3)废渣中的主要成分除了LiF外,还有____________________。
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是___________________。
(5)在空气中加热10.98g草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。已知:M(CoC2O4·2H2O)=183g/mol。
温度范围/℃ | 固体质量/g |
150~210 | 8.82 |
290~320 | 4. 82 |
890~920 | 4.5 |
经测定,加热到210℃时,固体物质的化学式为__________________。加热到210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是_________________________。温度高于890℃时,固体产物发生分解反应,固体产物为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com