
| A. | 熔点:金刚石>食盐>干冰 | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 沸点:HF>HBr>HCl | D. | 离子半径:Na+<Mg2+<Al3+ |
分析 A.熔点:原子晶体>离子晶体>分子晶体;
B.元素的非金属性越强,其氢化物的稳定性越强;
C.结构相似的分子晶体,分子晶体的熔沸点与其相对分子质量成正比,但含有氢键的熔沸点较高;
D.电子层结构相同的离子,离子半径随着原子序数增大而减小.
解答 解:A.熔点:原子晶体>离子晶体>分子晶体,金刚石是原子晶体、食盐是离子晶体、干冰是分子晶体,所以熔点:金刚石>食盐>干冰,故A正确;
B.元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>S>P,所以氢化物的稳定性:HCl>H2S>PH3,故B正确;
C.结构相似的分子晶体,分子晶体的熔沸点与其相对分子质量成正比,但含有氢键的熔沸点较高,这几种氢化物都是分子晶体,但HF中含有氢键,所以沸点:HF>HBr>HCl,故C正确;
D.电子层结构相同的离子,离子半径随着原子序数增大而减小,这几种离子电子层结构相同,原子序数Na<Mg<Al,所以离子半径Na+>Mg2+>Al3+,故D错误;
故选D.
点评 本题考查晶体熔沸点高低判断、离子半径大小比较、氢化物的稳定性等,明确晶体类型及晶体熔沸点高低影响因素是解本题关键,分子晶体与分子间作用力有关、原子晶体与共价键强弱有关、金属晶体与金属键强弱有关、离子晶体与晶格能大小有关,知道非金属性强弱判断方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 温度/℃\CO的体积分数%\投料比 | $\frac{n({H}_{2}O)}{n(CO)}$=1 | $\frac{n({H}_{2}O)}{n(CO)}$=3 | $\frac{n({H}_{2}O)}{n(CO)}$=5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石炭酸与NaOH溶液混合:H++OH-→H2O | |
| B. | 稀HNO3洗涤试管中的银镜:Ag+NO3-+2H+═Ag++NO↑+H2O | |
| C. | 乙烯使酸性KMnO4褪色:5C2H4+12MnO4-+36H+→12Mn2++10CO2↑+28H2O | |
| D. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N、O、S | B. | Cl、S、O | C. | Si、P、N | D. | S、Cl、F |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +2HNO3$→_{100-110℃}^{浓硫酸}$
+2HNO3$→_{100-110℃}^{浓硫酸}$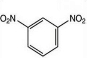 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
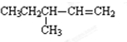
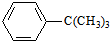 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ②③④ | C. | ①③⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2→H+H | B. | H+Cl→HCl | ||
| C. | H2O(l)→H2O(g) | D. | CaCO3$\stackrel{高温}{→}$CaO+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 正极反应为Ag-e-=Ag+ | |
| B. | 放电时,交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 当电路中转移0.1mol e-,通过交换膜的阳离子为0.2mol | |
| D. | 用KCl溶液代替盐酸,则电池总反应不改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com