
| A. | Na2CO3 是碱 | B. | Na2C03 是盐 | C. | Na2C03是钠盐 | D. | Na2CO3是碳酸盐 |
分析 A.根据碱的定义和组成进行解答;
B.根据盐的定义由酸根离子和金属离子构成的化合物分析;
C.根据含有钠元素的盐叫钠盐分析;
D.根据含有碳酸根离子的盐叫碳酸盐分析;
解答 解:A.碱是指电离时生成的阴离子全部是氢氧根离子的化合物,Na2C03俗名纯碱是因为:碳酸钠是弱酸强碱盐,水解CO32-+H2O?HCO3-+OH-,溶液呈碱性,故A错误;
B.Na2C03由碳酸根离子和钠离子构成的化合物,属于盐,故B正确;
C.Na2C03属于含有钠元素的盐,故C正确;
D.Na2COa由碳酸根离子和钠离子构成的盐,属于碳酸盐,故D正确;
故选A.
点评 本题考查物质的分类,为高频考点,侧重于学生的基本概念的理解和把握,难度不大,注意把握分类标准以及方法.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:解答题
 铬(Cr)是周期表中VIB族元素,化合价可以是 0~+6 的整数价态.回答下列问题:
铬(Cr)是周期表中VIB族元素,化合价可以是 0~+6 的整数价态.回答下列问题: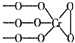 ,则Cr的化合价为+5.
,则Cr的化合价为+5.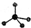 .CrO72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个角顶氧原子彼连,结构为
.CrO72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个角顶氧原子彼连,结构为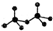 .则由n(n>1)个CrO42-通过角顶氧原子连续的链式结构的化学式为CrnO(3n+1)2-.
.则由n(n>1)个CrO42-通过角顶氧原子连续的链式结构的化学式为CrnO(3n+1)2-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由①只能确定溶液中有Al3+、Mg2+,没有HCO3- | |
| B. | 由②知溶液中有SO42-,没有Ba2+ | |
| C. | 由③确定溶液中有Na+,没有K+ | |
| D. | 若检验溶液中是否有存在Cl-,可取少许原溶液,直接向其中加入AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
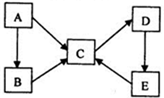 己知X、Y、Z、W为短周期四种常见元素,其中X是原子半径最小的元素,Y原子的最外层电子数是内层电子数二倍,Z能和X形成两种常见的液态化合物,W元素的单质既能与盐酸反应也能与NaOH溶液反应.元素Q是地壳中含量第二位的金属元素.试回答下列问题:
己知X、Y、Z、W为短周期四种常见元素,其中X是原子半径最小的元素,Y原子的最外层电子数是内层电子数二倍,Z能和X形成两种常见的液态化合物,W元素的单质既能与盐酸反应也能与NaOH溶液反应.元素Q是地壳中含量第二位的金属元素.试回答下列问题: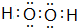 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
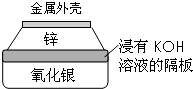 金属作为一种能源受到越来越多的关注.
金属作为一种能源受到越来越多的关注.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
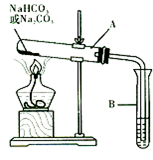 某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计
某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二. 无色,无气味并且易燃.是常见的一种基础能源.
无色,无气味并且易燃.是常见的一种基础能源.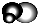 有强氧化性的弱酸,可以用于消毒杀菌.
有强氧化性的弱酸,可以用于消毒杀菌.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 键能 | 半径 | 键的极性 | 沸点 |
| H-Cl>H-I | Cl-<Br- | H-Cl>H-Br | HF>HI |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com