
下列叙述中能说明金属A肯定比金属B的活泼性强的是 ( )
A.A原子的最外层电子数比B原子的最外层电子数少
B.A原子电子层数比B原子电子层数多
C.1mol A从酸中置换出的H2比1molB从酸中置换的H2多
D.常温时,A能从稀盐酸中置换出氢,而B不能
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
高锰酸钾在实验率和工农业生产中有广泛的用途.实验率以二氰化锰为主要原料制备高锰酸钾。其部分流程如下:

(1)第①步加热熔融应在 中进行.而不用瓷坩埚的原因是 (用化学程式表示)。
(2)第④步通入CO2,可以使Mn(片发生反应.生成MnO4—,和MnO3—反应的离子方程式为
。则完成反应时,转化为KMnO4,的KMnO4,占全部K2MnO4,的百分率约为
(精确到0.1%)。
(3)第⑤步趁热过滤的是 。
(4)第⑥步加热浓缩至液面有细小品体析出时.停止加热.冷却结品、 、洗涤、干燥。干燥过程中.温度不宜过高.其原因是 (用化学方程式表示)。
(5)H2O2和KMnO4,都是常用的强氰化剂。若向H2O2溶液中滴加酸性高锰酸钾溶液.则酸性高锰酸钾溶液会褪色.写出该反应的离子方程式: .该反应说明H2O2的氰化性比KMnO4, (填“强”或“弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
钛是20世纪50年代发展起来的一种重要的结构金属,钛合金因具有强度高、耐蚀性好、耐热性高等特点而被广泛用于各个领域。
(1)与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的元素有 (填元素符号)。
(2)[Ti(OH)2(H2O)4]2+中的化学键有 。
a.σ键 b.π键 c.离子键 d.配位键
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如下图所示。
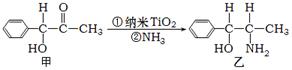
 化合物甲的分子中采取sp2杂化方式的碳原子个数为 ,化合物乙中采取sp3杂化的原子的第一电离能由小到大的顺序为 。
化合物甲的分子中采取sp2杂化方式的碳原子个数为 ,化合物乙中采取sp3杂化的原子的第一电离能由小到大的顺序为 。
(4)有一种氮化钛晶体的晶胞如右图所示,该晶体的化学式为 ,该晶体中Ti原子周围与它距离最近且相等的N原子的个数______。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是( )
A.元素原子的最外层电子数等于元素的最高化合价
B.多电子原子中,在离核较近的区域内运动的电子能量较高
C.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强
D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
查看答案和解析>>
科目:高中化学 来源: 题型:
铍元素性质与铝元素性质相似,下列方法能证明氯化铍由共价键构成的是( )
A.溶于水加硝酸银溶液,观察是否有白色沉淀生成
B.溶于水做导电实验,观察是否导电
C.熔融状态,做导电实验,观察是否导电
D.测定氯化铍熔点
查看答案和解析>>
科目:高中化学 来源: 题型:
将1.00 mol·L-1 NaOH溶液滴入20.00 mL 1.00 mol·L-1的一元酸HA溶液中,测得混合溶液的pH和温度随加入NaOH溶液体积变化曲线如图所示。
(1)计算室温时20.00 mL 1.00 mol·L-1的一元酸
HA的电离度α=________。
 (2)图中B点所示的溶液中所含各离子浓度由
(2)图中B点所示的溶液中所含各离子浓度由
大到小的顺序是_____。
(3)下列说法正确的是________(填相应序号)。
A.由图中可知NaOH和HA反应的ΔH>0
B.图中C点所加NaOH溶液的体积V=20.00 mL
C.图中C点时溶液的KW略大于1×10-14 mol·L-1,溶液中c(H+)=1×10-7 mol·L-1
D.图中D点后,溶液温度略下降的主要原因是生成的NaA水解吸热
(4)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入
0.1 mol·L-1 HCl溶液40 mL,溶液中含碳元素的各种微粒
(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的
部分情况如图所示。]回答下列问题:
① 在同一溶液中,H2CO3、HCO 、CO
、CO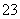
______(填“能”或“不能”)大量共存;
② 当pH=7时,溶液中含碳元素的主要微粒为________,溶液中各种离子的物质的量
浓度的大小关系为________________________________;
③ 已知在25 ℃时,CO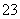 水解反应的平衡常数即水解常数Kh=2×10-4 mol·L-1,当溶
水解反应的平衡常数即水解常数Kh=2×10-4 mol·L-1,当溶
液中c(HCO )∶c(CO
)∶c(CO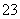 )=2∶1时,溶液的pH=________。
)=2∶1时,溶液的pH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,向一定体积0.1 mol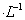 的氨水中逐滴滴加 0. 1mol
的氨水中逐滴滴加 0. 1mol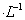 的盐酸,溶液中pH与pOH[注:pOH=-lgc(OH-)] 的变化关系如右图所示,则下列说法中错误的是
的盐酸,溶液中pH与pOH[注:pOH=-lgc(OH-)] 的变化关系如右图所示,则下列说法中错误的是
A.M点所示溶液中c( NH4+)>c(Cl-)
B.Q点所示溶液的导电熊力强于M点
C.Q点消耗盐酸的体积等于氨水的体积
D.M点和N点所示溶液中水的电离程度相同

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com