
����Ŀ�����ײ���һֱ�������о�����Ҫ���⣬��������Fe�۱�������г�ǿ�Ĵ��ԡ���Ч���Ե����������ʡ�
��.ʵ���Ҳ������ԭ���Ʊ�����Fe����������ͼ��ʾ����
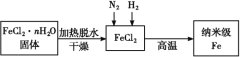
��1������Fe��ϡ���ᷴӦ�����ӷ���ʽΪ_____��
��2����ν�FeCl2��nH2O���������ˮ�Ƶ���ˮFeCl2��____(�ü�Ҫ��������)��
��3����������Fe�Ļ�ѧ����ʽΪ____��
��.�������ϣ��ڲ�ͬ�¶��£�����Fe����ˮ������Ӧ�Ĺ�����ﲻͬ���¶ȵ���570��ʱ����FeO������570��ʱ����Fe3O4����ͬѧ��ͼ����ʾװ�ý�������Fe����ˮ������Ӧ��ʵ�飬��ͬѧ��ͼ����ʾ��װ�ý�������Fe����ˮ�����ķ�Ӧ����֤���

��4����װ��������Fe����ˮ������Ӧ�Ļ�ѧ����ʽ��_____��
��5����װ��������a������Ϊ_____��
��6����ͬѧ��ȡ5.60gFe�ۣ�����װ�÷�Ӧһ��ʱ���ֹͣ���ȡ����Թ��ڵĹ��������ڸ���������ȴ�Ƶ�����Ϊ6.88g����ͬѧʵ���Ĺ������������������������Ϊ_____(���������λ��Ч����)��
���𰸡�Fe+2H+=Fe2++H2�� �ڸ����HCl�����м��� FeCl2+H2![]() Fe+2HCl Fe+H2O(g)
Fe+2HCl Fe+H2O(g)![]() FeO+H2 ������ 67.4%
FeO+H2 ������ 67.4%
��������
��.��1���������ᷴӦ�����Ȼ�������������
��2��FeCl2nH2O���������ˮʱ������������ˮ�������������������Ȼ��⣬Ϊ��ֹˮ����Խ�����HCl��Χ�м��ȣ�
��3����������ͼ��֪���ڸ�����������������ԭ�Ȼ������ɵ�����Fe��
��.��4��Fe����ˮ�����ڼ��������·�Ӧ����FeO��������
��5�����������Ľṹ������ȷ������a�����ƣ�
��6������ˮ������Ӧ������������������������Ϲ������������ж�������ɷ֡�
��.��1���������ᷴӦ�����Ȼ������������������ӷ�Ӧ����ʽΪFe+2H+=Fe2++H2����
��2��FeCl2nH2O���������ˮͨʱ������������ˮ�������������������Ȼ��⣬Ϊ��ֹFeCl2ˮ�⣬FeCl2nH2O���������ˮͨ��Ҫͨ������HCl���壬HCl������FeCl2ˮ�⣬��ͨ���HCl����ɴ���ˮ����������FeCl2nH2O������ˮ���ʴ�Ϊ���ڸ����HCl�����м��ȣ�
��3����������ͼ��֪���ڸ�����������������ԭ�Ȼ������ɵ�����Fe����Ӧ����ʽΪ![]() ��
��
��. ��4��Fe����ˮ�����ڼ��������·�Ӧ����FeO������������ʽΪ![]() ��
��
��5����װ��������a������Ϊ�����ʴ�Ϊ��������
��6������װ�÷�Ӧ����Ӧ�¶ȸ���570������Fe����ˮ������Ӧ�Ĺ������ΪFe3O4����Ӧ�����ù��������Ϊ6.88g��������ԭ�ӵ�����Ϊm(O)=6.88g-5.60g=1.28g����n(O)=![]() =0.08mol���ɹ�ϵʽ1Fe3O4��4O���ɵ�n��Fe3O4��=0.02mol�����Թ������������������������=
=0.08mol���ɹ�ϵʽ1Fe3O4��4O���ɵ�n��Fe3O4��=0.02mol�����Թ������������������������=![]() ��100%��67.4%���ʴ�Ϊ��67.4%��
��100%��67.4%���ʴ�Ϊ��67.4%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ͬ�¶���ˮ��Һ��c(H��)��c(OH��)�Ĺ�ϵ�������ж���ȷ����( )

A. ֻ�������µķ�ʽ������a����d��
B. T<25
C. b���c��pH��Ϊ6����Һ������
D. ������������������c (H��) ��c (OH��)��Kw
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ʱ�������г������ɣ�����˵������ȷ����![]()
A.![]() ��
��![]() ���ת���������仯
���ת���������仯
B.![]() ��
��![]() ��Ϊͬ������
��Ϊͬ������
C.�����ʵ�����![]() ��
��![]() ���е�����������ͬ
���е�����������ͬ
D.����ͬ���¶���ѹǿ�£��������![]() ��
��![]() ������ͬ�ķ�����
������ͬ�ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ���ܴ���������ǣ� ��
A.0.1molL-1KI��Һ��Na+��Ba2+��Fe3+��OH-
B.0.1motL-1Fe2(SO4)3��Һ��Zn2+��NH![]() ��Br-��SO
��Br-��SO![]()
C.0.1molL1HNO3��Һ��Ba2+��K+��ClO-��Cl-
D.0.1molL-1NaAlO2��Һ��Mg2+��Na+��SO![]() ��HCO
��HCO![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)����(�ֳ��£�N2H4,��ɫҺ��)Ϊ��Ԫ�����ˮ�еĵ��뷽ʽ�백���ơ�д����ˮ��������һ�����뷴Ӧ�ķ���ʽ_______________���Ȼ�þ��Һ��ij�����¿���Mg(OH)Cl��������д��������ӷ���ʽ_________
(2)ʵ���ҿ�ͨ����ʢװ�м�ʯ�ҵ���ƿ�еμ�Ũ��ˮ����ȡ��������������ػ�ѧ��Ӧԭ��������______________________________
(3)��������10mL0.1 mol/L NaOH��Һ�м���0.1mol/L��һԪ��HA,��ҺpH�ı仯������ͼ��ʾ

��HAΪ_______�����(����ǿ����������)��a����ʾ��Һc(Na)_____c(A)(����>������<��������=)��a��b������ʾ��Һ��ˮ�ĵ���̶�a_______b(����>������<������"=)��
(4)25��ʱ0.05mol/L�Ĵ�����Һ��pH=______ ����Һ��ˮ�������c(H+)=____(��֪�����´������ƽ�ⳣ��Ϊ2.0��10-5)
(5)�����£�0.01mol/L��HCN��Һ��ˮϡ��1000���Ĺ����У�����ѡ���������_____
A.![]() B.Kac(HCN) C.
B.Kac(HCN) C.![]() D.
D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽ��д��
��1��S+Ca(OH)2��CaS5+CaS2O3+H2O___��
��2��H2O2+Cr2(SO4)3+ ��K2SO4+K2CrO4+H2O___��
��3������þ���뺬��KSCN����������������Һ���������ֺ�ɫ��д����ط�Ӧ�����ӷ���ʽ___��
��4��д�����Ȼ�����Һ��ȡ��ͭ��ʯ����Ҫ�ɷ���Cu2S)������Ӧ�����ӷ���ʽ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������س���������ɱ����ˮ�ʾ������ȡ�ijС�������̿�(��Ҫ��MnO2,����������SiO2��Al2O3��Fe2O3������)ģ�ҵ�Ƹ�������������¡��Իش��������⡣
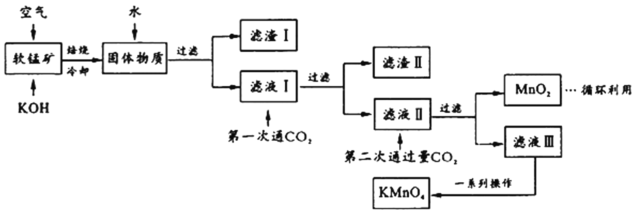
(1)��ƽ����ʱ��ѧ��Ӧ��________MnO2��________��________O2![]() ________K2MnO4��________H2O����ҵ�����в��öԿ�����ѹ�ķ������MnO2�����ʣ�������ײ���۽�����ԭ��___________________________��
________K2MnO4��________H2O����ҵ�����в��öԿ�����ѹ�ķ������MnO2�����ʣ�������ײ���۽�����ԭ��___________________________��
(2)������ijɷ���_________(��ѧʽ)����һ��ͨCO2������ϡ��������ԭ����_____________��
(3)�ڶ���ͨ�����CO2����MnO2�����ӷ���ʽΪ________________________��
(4)����Һ�����һϵ�в�����KMnO4��
��ͼ��֪������Һ��õ�KMnO4�辭��__________��___________��ϴ�ӵȲ�����
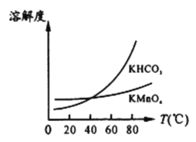
(5)��ҵ�ϰ���������������������MnO2 a%�����̿�1�֣�������������KMnO4____________�֡���������С�������λ��
(6)���õ�ⷨ�ɵõ�������KMnO4�ö��Ե缫�����Һ��
�ٵ���������ӦʽΪ________________________________��
�������������������������������____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2��CH4���Ƶúϳ�����CH4(g)��CO2(g)2CO(g)��2H2(g) ��H=+247 kJ��mol��1����ʼ�¶Ⱦ�ΪT Kʱ����3�������а���ͬ��ʽͶ�뷴Ӧ�����������Ӧ�������Ϣ���±���
���� | ��ʼ���ʵ���/mol | CO2ƽ��ת����(��) | |||||
��� | �ݻ�/L | ���� | CH4(g) | CO2(g) | CO(g) | H2(g) | |
�� | 2 | ���º��� | 2 | 1 | 0 | 0 | 50% |
�� | 1 | 0.5 | 1 | 0 | 0 | ||
�� | 1 | ���Ⱥ��� | 1 | 0.5 | 0 | 0 | �� |
����˵����ȷ����
A.T Kʱ����ӦCH4(g)��CO2(g)2CO(g)��2H2(g)��ƽ�ⳣ��Ϊ1/3
B.�������з�Ӧ�ﵽƽ��ʱ����(CO2����)=50%
C.�������з�Ӧ�ﵽƽ��ʱ��Ӧ����123.5��247 kJ��mol��1��Χ��
D.�������з�Ӧ�ﵽƽ��ʱ����Ͷ��0.5 mol CH4��0.25 mol CO����Ӧ�ﵽ��ƽ��ǰ��v(��)<v(��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����V L NH3(������ɱ�״����)ͨ��1 Lˮ�У��γ��ܶ�Ϊ�� g��cm-3�İ�ˮ����������Ϊw�����к�NH3�����ʵ���Ϊa mol������˵����ȷ����
A.���ʵ����ʵ���Ũ��c =![]() mol��L-1
mol��L-1
B.���ʵ��������� w=![]() ��100%
��100%
C.��Һ��c(OH-)= amol��L-1
D.������Һ����ͨ����ԭ��Һ�������ˮ��������Һ��������������0.5w
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com