
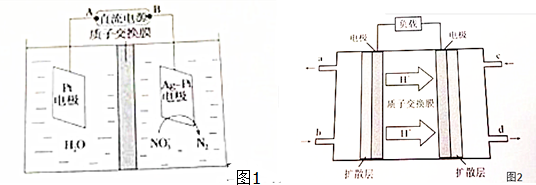


科目:高中化学 来源: 题型:
| A、D的气态氢化物比A的气态氢化物稳定 |
| B、A的常见氧化物是一种酸性氧化物,能与水反应生成一种弱酸 |
| C、B的最高价氧化物对应的水化物是酸性最强的含氧酸 |
| D、单质C常温下能与水反应生成一种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
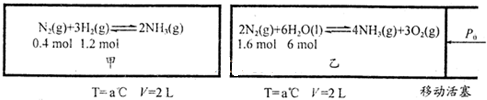
查看答案和解析>>
科目:高中化学 来源: 题型:
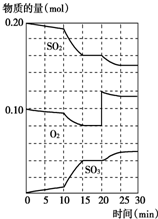 600℃时,在一固定容积的密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0.反应过程中SO2、O2、SO3物质的量的变化如图,下列说法错误的是( )
600℃时,在一固定容积的密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0.反应过程中SO2、O2、SO3物质的量的变化如图,下列说法错误的是( )| A、反应从开始到第一次平衡时,二氧化硫的转化率为20% |
| B、10~15 min和20~25min相比,前者的化学反应速率大 |
| C、反应进行至20min时,曲线发生变化是因为通入了氧气 |
| D、反应进行到10min~15 min的曲线变化原因一定是增大了压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
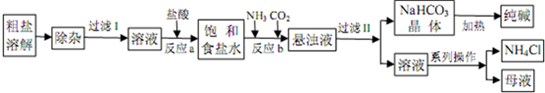
| 等级 | 优等品 | 一等品 | 合格品 |
| Na2CO3含量 | ≥99.2 | ≥98.8 | ≥98.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、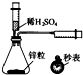 测定一定时间内生成H2的反应速率 |
B、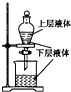 提取海带中的碘 |
C、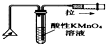 检验火柴燃烧产生的SO2 |
D、 证明非金属性:Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
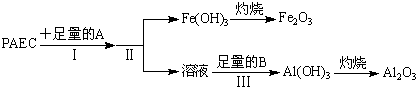
| 过量稀盐酸 |
| 试剂X |
| HCl(或NaOH) |
| 调节pH |
| 水解 |
| 聚合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com