
| A. | H与D、16O与18O互为同位素,H216O、D216O、H218O、D218O互为同分异构体 | |
| B. | 金刚石、石墨均为碳的同素异形体,其化学性质与物理性质均不相同 | |
| C. |  石墨烯(结构如图所示)是由碳原子构成的单层片状结构的新材料,与石墨互为同位素 | |
| D. | 由于氢原子可以形成H-(如NaH),所以有人建议可将氢元素排在元素周期表的ⅦA族 |
分析 A.具有相同质子数、不同中子数的原子为同位素;具有相同分子式、不同结构的有机物互为同分异构体;
B.同位素的化学性质相同;
C.石墨烯与石墨均是碳元素形成的单质;
D.ⅦA族元素原子在反应中易获得一个电子,在化合物中元素的化合价为-1价.
解答 解:A.H216O、D216O、H218O、D218O是同种物质,故A错误;
B.金刚石、石墨均为碳的同素异形体,同位素的化学性质相同,故B错误;
C.石墨烯与石墨均是碳元素形成的单质,应是互为同素异形体的关系,而同位素应是同一元素不同原子间的互称,故C错误;
D.H原子得到一个电子实现最外电子层稳定结构,在化合物中元素的化合价为-1价,符合ⅦA族元素的化合价,故D正确.
故选D.
点评 本题考查同位素、同素异形体以及原子结构与元素性质,明确ⅦA族元素的性质,寻找H元素与ⅦA族元素性质的共同点,难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | |
| B. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| C. | 一定温度下,反应MgCl2(l)═Mg(l)+Cl2(g)的△H<0,△S>0 | |
| D. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y2+ | B. | X2+ | C. | Z2+ | D. | H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +2Na→
+2Na→ +H2↑
+H2↑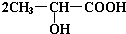 +Na2CO3→
+Na2CO3→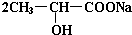 +H2O+CO2↑,
+H2O+CO2↑,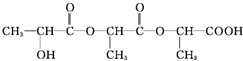

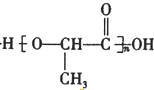
 $→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.
$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| B. | 25℃时,1L pH=13的Ba(OH)2溶液中含Ba2+的数目为0.1NA | |
| C. | 12g金刚石中含有的共价键数为2NA | |
| D. | 7.1g氯气与足量热烧碱溶液反应,转移电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+,Na+,Br-,Fe3+ | B. | H+,K+,MnO${\;}_{{4}^{\;}}$-,C2O42- | ||
| C. | K+,H+,NO3-,I- | D. | Na+,H+,SO32-,S2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
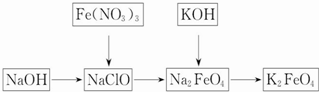
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com