
| A、0.1mol-NH2(氨基)中含有的电子数目为1.0NA |
| B、常温下,1L 0.1mol?L-1 CH3COONa溶液中含有的CH3COO-和Na+总数为0.2NA |
| C、标准状况下,2.24 LH2O中含有的原子总数为3NA |
| D、常温常压下,16 g O2和O3混合气体含有的氧原子数为NA |
| 16g |
| 16g/mol |


科目:高中化学 来源: 题型:
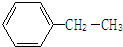
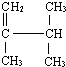
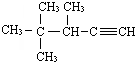
 表示的分子式
表示的分子式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,1 mol羟基(-OH)所含的电子数为10 NA |
| B、由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2 g H2,则电路中通过0.2 mol电子 |
| C、在标准状况下,11.2 L NO与11.2 L 02混合后气体分子数为0.75 NA |
| D、l mol Na202,与足量水反应,转移电子的物质的量为2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、②④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
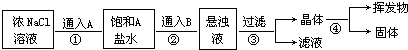
查看答案和解析>>
科目:高中化学 来源: 题型:
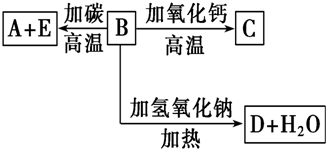
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓氨水可检验氯气管道泄漏 |
| B、明矾可用作除去污水中悬浮颗粒的絮凝剂 |
| C、Si和SiO2都用于制造光导纤维 |
| D、硬铝、青铜和不锈钢都属合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 0.01mol?L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol?L-1Na2SO3 溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com