
实验室欲配制一种仅含四种离子(不考虑来源于水电离的离子)的溶液,且溶液中四种离子的浓度均相等,能达到此目的的是( )
A.Na+、Mg2+、SO 、Cl-
、Cl-
B.ClO-、I-、NH 、Ba2+
、Ba2+
C.Na+、AlO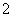 、K+、HCO
、K+、HCO
D.Al3+、K+、SO 、NO
、NO
科目:高中化学 来源: 题型:
碱式碳酸铝镁
[ MgaAlb(OH)c(CO3)d·xH2O]常用作塑料阻燃剂。
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和____________。
(2)MgaAlb(OH)c(CO3)d·xH2O中a、b、c、d的代数关系式为________。
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390 g样品与足量稀盐酸充分反应,生成CO2 0.560 L(已换算成标准状况下)。
②另取一定量样品在空气中加热,样品的固体残留率(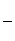 ×100%)随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。
×100%)随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。
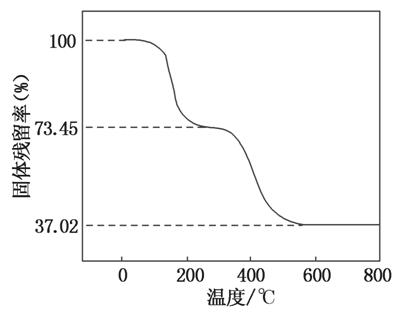
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)n(CO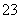 )(写出计算过程)。
)(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
利用“化学计量在实验中的应用”的相关知识进行填空
(1)在标准状况下,0.5mol任何气体的体积都约为 L。
(2)1.5mol H2SO4的质量是 ,所含分子数目为 。
(3)配制500mL 1mol/L HNO3溶液,需16mol/L HNO3溶液的体积为 mL.
(4)在9.5g某二价金属的氯化物中含0.2mol Cl—,此氯化物的摩尔质量为 ;
该金属元素的相对原子质量为 。
(5)在一定的温度和压强下,1体积X2 (g)跟3体积Y2 (g)化合生成2体积化合物,则该化合物的化学式是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.Cu(OH)2中加入硫酸:OH-+H+===H2O
B.钠加入水中:Na+2H2O===Na++2OH-+H2↑
C.FeSO4溶液中加入稀硝酸:3Fe2++4H++NO ===3Fe3++2H2O+NO↑
===3Fe3++2H2O+NO↑
D.Al2(SO4)3溶液中加入足量Ba(OH)2溶液:2Al3++3SO +3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:10AgF+5Cl2+5H2 O===9AgCl+AgClO3+10HF+O2
O===9AgCl+AgClO3+10HF+O2
下列关于该反应的叙述不正确的是( )
A.该反应中,氧化剂与还原剂物质的量之比为95
B.当反应中有1 mol电子转移时,被还原氯气物质的量为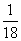 mol
mol
C.每产生1 mol O2时,被氧元素还原的氯气物质的量为2 mol
D.参加反应的水有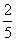 被氧化
被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定溶液中一定能大量共存的是( )
A.25 ℃时, pH=12的无色溶液:K+、Br-、SO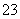 、SiO
、SiO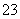
B.与铝粉反应放出氢气的溶液:HCO 、K+、Na+、SO
、K+、Na+、SO
C.使石蕊溶液显红色的溶液:Na+、NH 、Cl-、S2O
、Cl-、S2O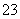
D.25 ℃时,由水电离出来的c(H+)=1×10-13 mol/L的溶液:Ba2+、Cl-、AlO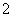 、NO
、NO
查看答案和解析>>
科目:高中化学 来源: 题型:
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO 。其过程如下:
。其过程如下:
mCeO2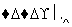 (m-x) CeO2·xCe+xO2
(m-x) CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2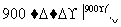 mCeO2+xH2+xCO
mCeO2+xH2+xCO
下列说法不正确的是( )
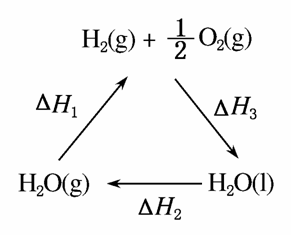
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.上图中ΔH1=ΔH2+ΔH3
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-===CO +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)请将下列五种物质:KBr、Br2、I2、KI、K2SO4分别填入下列横线上,组成一个未配平的化学方程式:
KBrO3+________+H2SO4—→________+________+________+________+H2O。
(2)如果该化学方程式中I2和KBr的化学计量数分别是8和1,则
①Br2的化学计量数是________;
②请将反应物的化学式及配平后的化学计量数填入下列相应的位置中:
KBrO3+ ________+ H2SO4—→;
③若转移10 mol e-,则反应后生成I2的物质的量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com