
分析 (1)已知:①N2(g)+2O2(g)=2NO2(g)△H1=+67.7kJ•mol-1;
③N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ•mol-1;
⑤H2O(l)=H2O(g)△H3=+44.0kJ•mol-1.
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)可以是反应③×2-①-⑤×4得到,由此分析解答;
(2)②2H2(g)+O2(g)=2H2O (g)△H2=-484kJ/mol;
③N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol;
④H2(g)+F2(g)=2HF(g)△H4=-538kJ/mol
依据盖斯定律④×2-②+③得到,由此分析解答.
解答 解:(1)已知:①N2(g)+2O2(g)=2NO2(g)△H1=+67.7kJ•mol-1;
③N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ•mol-1;
⑤H2O(l)=H2O(g)△H3=+44.0kJ•mol-1.
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)可以是反应③×2-①-⑤×4得到,
所以该反应的焓变=(-534kJ•mol-1)×2-67.7kJ•mol-1-(+44kJ•mol-1)×4=-1311.7kJ/mol,
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1311.7kJ/mol;
(2)②2H2(g)+O2(g)=2H2O (g)△H2=-484kJ/mol;
③N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol;
④H2(g)+F2(g)=2HF(g)△H4=-538kJ/mol
依据盖斯定律④×2-②+③得到热化学方程式为:N2H4(g)+2F2(g)=N2(g)+4HF(g)△H=-1126KJ/mol;
故答案为:N2H4(g)+2F2(g)=N2(g)+4HF(g)△H=-1126KJ/mol.
点评 本题考查了热化学方程式的书写方法和盖斯定律的计算应用,题目较简单.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 反应可表示为X+3Y?2Z,平衡常数为1600 | |
| C. | 其他条件不变时,增大压强可使平衡常数增大 | |
| D. | 改变温度可以改变该反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
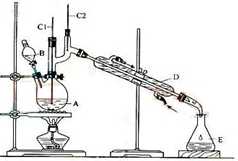 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能kJ/mol | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
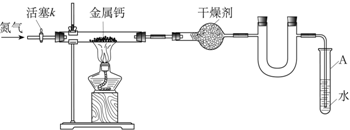
| 空硬玻璃管质量m0/g | 硬玻璃管与钙的质量m1/g | 硬玻璃管与产物的质量m2/g |
| 114.8 | 120.8 | 122.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L 水蒸气含有的分子数为1NA | |
| B. | 常温常压下,32 g O2含有的原子数为2个 | |
| C. | 常温常压下,NA个CO2分子占有的体积为22.4 L | |
| D. | 体积为1L、物质的量浓度为0.5 mol/L的氯化钙溶液中,含有Cl-个数为1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com