
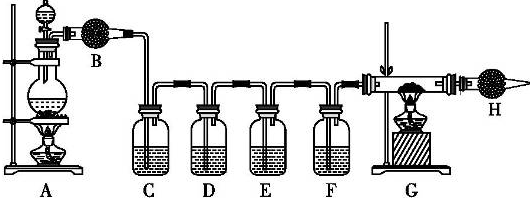
分析 (1)碳与浓硫酸在加热条件下反应生成二氧化碳、二氧化硫气体和水;稀硫酸与铁反应生成硫酸亚铁和氢气;
(2)要检验二氧化碳、二氧化硫和水,需要先用无水硫酸铜粉末检验水;
(3)C装置中盛放品红溶液,用于检验二氧化硫,D中盛放酸性高锰酸钾溶液用于除去二氧化硫,E中盛放品红溶液用于检验二氧化硫是否除尽,F中用澄清石灰水检验二氧化碳;
(4)G装置用于检验氢气,根据装置特点可知其盛放的药品为氧化铜;氢气能够将黑色的氧化铜还原成红色的铜;
(5)氢气纯度步骤时容易发生爆炸,需要先点燃A处酒精灯排除装置空气;氢气为引燃气体,不能直接排放,需要使用尾气吸收装置.
解答 解:(1)生铁中的碳与浓硫酸反应生成生成二氧化硫、二氧化碳和水,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;浓硫酸变成稀硫酸后,稀硫酸与铁反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;Fe+H2SO4=FeSO4+H2↑;
(2)为了避免后面溶液对水的检验的干扰,需要先用无水硫酸铜粉末检验水,所以B中盛放的为无水硫酸铜粉末,
故答案为:无水硫酸铜粉末;
(3)用C装置的品红溶液检验二氧化硫气体,用D中的酸性高锰酸钾溶液除去二氧化硫,为了避免二氧化硫对二氧化碳检验的干扰,则E中应该盛放品红溶液用于检验二氧化硫是否除尽,然后用F中的澄清石灰水检验二氧化碳,
故答案为:检验二氧化碳是否除尽,避免其对二氧化碳的检验造成干扰;
(4)该反应中有氢气生成,需要用氢气还原氧化铜的反应检验,所以G装置中盛放的为氧化铜,氢气在加热条件下能够将黑色的氧化铜还原成红色的铜,
故答案为:氧化铜;黑色粉末变成红色粉末;
(5)氢气为引燃气体,纯度不足容易发生爆炸,所以需要先点燃A处酒精灯,将装置中空气排净后再点燃G处酒精灯;氢气为易燃气体,排放到空气中容易发生爆炸,需要使用尾气吸收装置,可以用气球收集H处导管排出的尾气,也可以在H处放一盏燃着的酒精灯将氢气点燃,
故答案为:G;是;用气球收集H处导管排出的尾气(或在H处放一盏燃着的酒精灯).
点评 本题考查了浓硫酸的性质、常见气体的检验,题目难度中等,明确常见气体的性质及检验的先后顺序为解答关键,注意掌握浓硫酸具有的性质及反应原理,明确化学实验基本操作方法及其应用,试题培养了学生达到分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
| W | 第二周期中一种非金属元素,第一电离能大于相邻元素 |
| X | 常见的金属,在周期表中的周期序数与族序数相等 |
| Y | 气态氢化物及其最高价氧化物对应的水化物均为强酸 |
| Z | 其原子质量数为56,中子数为30的核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
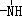 、
、 一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.
一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
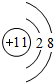 ,C的原子结构示意图是
,C的原子结构示意图是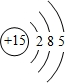 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 B是化学实验室中最常见的有机物,其产量可以用来衡量一个国家的石油化工发展水平,还是一种植物生长调节剂.并能进行如图所示的反应.且D能发生加聚反应.
B是化学实验室中最常见的有机物,其产量可以用来衡量一个国家的石油化工发展水平,还是一种植物生长调节剂.并能进行如图所示的反应.且D能发生加聚反应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼元素、钙元素、铜元素在化学中有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.
硼元素、钙元素、铜元素在化学中有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com