
【题目】近年我国高铁迅猛发展,为人们的出行带来了极大的便利。曾经利用如下反应焊接铁轨:2Al+Fe2O3 ![]() 2Fe + Al2O3 。请回答下列问题:
2Fe + Al2O3 。请回答下列问题:
(1)该反应属于_______________反应(填“放热”或“吸热”)。
(2)该反应的反应类型是_______________(填字母)。
A.化合反应 B.置换反应C.复分解反应 D.分解反应
(3)该反应中的氧化剂是_______________(填化学式)。
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点为33℃,沸点为73℃,氯气与单质碘需在温度稍低于70℃下反应制备ICl3。实验室可用如图装置制取ICl3。下列说法正确的是( )

A.装置A可选用的药品为二氧化锰与浓盐酸
B.装置B的作用是除杂,也作安全瓶,能监测实验进行时装置C中是否发生堵塞
C.装置C中的硅胶可用碱石灰代替
D.装置D最恰当的加热方式为酒精灯直接加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
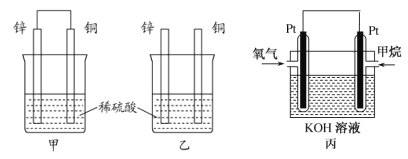
①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度: 甲__________乙(填“>”、 “<”或“=”)。
③请写出图中构成原电池的负极电极反应式: ____________。
④当甲中溶液质量增重 31.5 克时,电极上转移电子数目为______。
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是 KOH。通甲烷一极的电极反应方程式为 ______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1824年法国巴拉尔发现溴。在他以前,有一家工厂曾将一瓶红棕色的液体送给德国化学家李比希检测,李比希凭经验武断地认为该液体为氯化碘![]() 化学式为ICl,性质和溴非常相似
化学式为ICl,性质和溴非常相似![]() 。后来看到巴拉尔发现溴的报道后,懊悔不已。下列关于ICl的有关说法中不正确的是
。后来看到巴拉尔发现溴的报道后,懊悔不已。下列关于ICl的有关说法中不正确的是
A.![]() 键为极性共价键
键为极性共价键
B.ICl分子为极性分子
C.![]() 间形成的是
间形成的是 ![]() 键
键
D.与NaOH溶液反应能生成![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为电解饱和食盐水装置,下列有关说法不正确的是
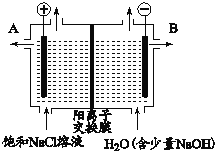
A. 左侧电极上发生氧化反应
B. 右侧生成的气体能使湿润的淀粉碘化钾试纸变蓝
C. 电解一段时间后,B口排出NaOH溶液
D. 电解饱和食盐水的离子方程式: 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为生活中常用药品:
A.碘酒 B.青霉素 C.阿司匹林
D.葡萄糖注射液 E.抗酸药(主要成分为碳酸氢钠)。
(1)上述药品中属于抗生素的是 _______ (填写字母,下同);
(2)能为人体直接提供能量的是 _______ ;
(3)下列关于药物使用的说法中,正确的是_______。
A.碘酒能使蛋白质变性,常用于外敷消毒
B.长期大量服用阿司匹林可预防疾病,没有毒副作用
C.使用青霉素,可直接静脉注射,不需进行皮肤敏感试验
D.随着平价药房的开设,生病了都可以到药店自己买药服用,不用到医院就诊
(4)碳酸氢钠可防治胃酸分泌过多,其发挥功效时的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。

(1)如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,图中可选用的发生装置是 ______ (填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3.36 L(标准状况)二氧化硫,如果已有40%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠 ______g(保留一位小数)。
(3)某热电厂上空大气中所含二氧化硫严重超标,现对该区域雨水样品进行探究。首先用pH试纸测定雨水样品的pH,操作方法为______,测得样品pH约为3;为进一步探究由SO2所形成酸雨的性质,将一定量的SO2通入蒸馏水中,配成pH为3的溶液,然后将溶液分为A、B两份,将溶液B久置于空气中,与密闭保存的A相比,久置后的溶液B中水的电离程度将 ______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业冶炼铜的原料,主要成分为 CuFeS2。试回答下列问题:
(1)基态硫原子核外电子有_____种不同运动状态,能量最高的电子所占据的原子轨道形状为_________。
(2)基态Cu原子的价层电子排布式为_________;Cu、Zn的第二电离能大小I2(Cu) _________I2(Zn)(填“>”“<”或“=”)。
(3)SO2分子中S原子的轨道杂化类型为_________,分子空间构型为_________;与SO2互为等电子体的分子有_________(写一种)。
(4)请从结构角度解释H2SO3的酸性比H2SO4酸性弱的原因_________。
(5)Cu(CH3CN)4比四氨合铜离子稳定,其配离子中心原子配位数为_________,配位体中σ键与π键个数之比为_________。
(6)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间距离为anm。则该晶体的密度为_________g/cm3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用文献资料设计方案对氯及其化合物进行探究。
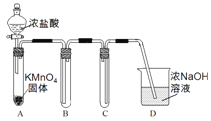
Ⅰ.用高锰酸钾和浓盐酸反应制取氯气
(1)该小组利用右图装置及试剂制备并收集适量Cl2,装置B、C的作用分别是___________、_______________。
(2)制得的氯气中加入适量水,得到饱和氯水,饱和氯水中含氯元素的微粒有____________(写出全部微粒)。
(3)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一。在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强。
①滤液漂白性增强的原因是________________(用化学平衡移动原理解释)。
②饱和氯水与石灰石反应生成HC1O的方程式是___________________。
Ⅱ. ClO3—、Cl—和H+反应的探究
(4)KClO3、KCl与硫酸可以反应。该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
烧杯编号 | 1 | 2 | 3 | 4 |
氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
氯化钾固体 | 1g | 1g | 1g | 1g |
水 | 8mL | 6mL | 3mL | 0mL |
硫酸(6mol/L) | 0mL | 2mL | (____)mL | 8mL |
现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, |
①该系列实验的目的_______________________。
②烧杯3取用硫酸的体积应为______________mL。
(5)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色。设计最简单的实验验证Cl2中含有ClO2______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com