
| A. | 合金中铁、锌的物质的量之和为0.02mol | |
| B. | 合金中铜的质量无法确定 | |
| C. | 合金中铁、铜的物质的量之和为0.01mol | |
| D. | 1.30g>铁和锌质量之和>1.12g |
分析 Cu与盐酸不反应,Zn、Fe与盐酸反应生成氢气,n(氢气)=$\frac{0.448L}{22.4L/mol}$=0.02mol,由电子守恒可知,Zn、Fe的物质的量之和为0.02mol,以此来解答.
解答 解:A.n(氢气)=$\frac{0.448L}{22.4L/mol}$=0.02mol,由电子守恒可知,Zn、Fe的物质的量之和为$\frac{0.02mol×2×(1-0)}{(2-0)}$=0.02mol,故A正确;
B.Zn、Fe的物质的量不确定,则Cu的质量无法确定,故B正确;
C.由选项A可知,Zn、Fe的物质的量之和为0.02mol,故C错误;
D.若与盐酸反应的金属只有Zn,其质量为0.02mol×65g/mol=1.30g,若与盐酸反应的金属只有Fe,其质量为0.02mol×56g/mol=1.12g,而Zn、Fe均反应,则1.30g>铁和锌质量之和>1.12g,故D正确;
故选C.
点评 本题考查混合物的计算,为高频考点,把握发生的反应及电子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法及极限法应用,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
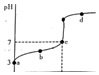 R知某温度电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0•1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )
R知某温度电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0•1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )| A. | a点表示溶液中c(CH3COO-)-定为10-3 mol/L | |
| B. | b点表示的溶液中c(Na+)<c(CH3COO-) | |
| C. | c点表示CH3COOH和NaOH恰好反应完全 | |
| D. | d点表示的溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$大于K |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 34S2-的结构示意图: | B. | H2O2的电子式: | ||
| C. | 甲烷分子的比例模型: | D. | 中子数为18的硫原子:${\;}_{16}^{18}$S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O所含原子个数大于3NA | |
| B. | 100ml18.4mol/L硫酸与足量Cu反应,生成SO2的分子数为0.92NA | |
| C. | t℃时,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×10-3NA | |
| D. | 100g质量分数为34.2%的蔗糖分子水溶液中含H原子数为2.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeSO4溶液中滴加NaOH浓液 | B. | 碳酸氢钠溶液中滴加稀盐酸溶液 | ||
| C. | 硫酸铁溶液中滴加硫氰化钾溶液 | D. | 氯化铁溶液中加入还原性铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
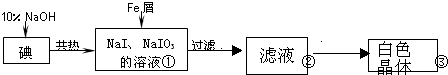
| 实验方案 | 实验现象 | 结论 |
| 将白色晶体溶于水,并滴2滴淀粉溶液 | 得到无色溶液 | / |
| 取少量溶液液于试管A中,加入足量的1mol/LH2SO4. | 溶液显蓝色 | 溶液中含IO3- |
| 另取少量溶液液于试管B中,滴入几滴酚酞溶液. | 溶液变红. | 溶液中含大量0H- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| HA | H2B | HC | ||
| Ka | Ka1 | Ka2 | Ka3 | Ka4 |
| 数值 | ||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com