
 ČķĆĢæó£ØÖ÷ŅŖ³É·ÖMnO2£¬ŌÓÖŹ½šŹōŌŖĖŲFe”¢Al”¢MgµČ£©µÄĖ®Šü×ĒŅŗÓėŃĢĘųÖŠSO2·“Ó¦æÉÖʱøMnSO4•H2O£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗMnO2+SO2ØTMnSO4£®
ČķĆĢæó£ØÖ÷ŅŖ³É·ÖMnO2£¬ŌÓÖŹ½šŹōŌŖĖŲFe”¢Al”¢MgµČ£©µÄĖ®Šü×ĒŅŗÓėŃĢĘųÖŠSO2·“Ó¦æÉÖʱøMnSO4•H2O£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗMnO2+SO2ØTMnSO4£®·ÖĪö £Ø1£©øł¾ŻMnO2+SO2=MnSO4æÉÖŖ£¬n£ØSO2£©=n£ØMnO2£©£»
£Ø2£©pH=7.1Ź±Mn£ØOH£©2æŖŹ¼³Įµķ£®ŹŅĪĀĻĀ£¬³żČ„MnSO4ČÜŅŗÖŠµÄFe3+”¢Al3+£¬½įŗĻAl£ØOH£©3ĶźČ«±ä³É³ĮµķŹ±µÄpH”¢Fe£ØOH£©3ĶźČ«±ä³É³ĮµķŹ±µÄpH·ÖĪö£»
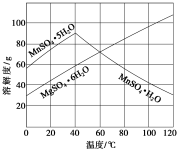
£Ø3£©“ÓMnSO4ŗĶMgSO4»ģŗĻČÜŅŗÖŠ½į¾§MnSO4•H2O¾§Ģ壬øł¾ŻĶ¼ÉĻŠÅĻ¢£¬øßÓŚ60”ęŅŌŗóMnSO4•H2OµÄČܽā¶Č¼õŠ”£¬¶ųMgSO4•6H2OµÄČܽā¶ČŌö“ó£¬Ņņ“ĖæŲÖĘ½į¾§ĪĀ¶Č·¶Ī§ŹĒøßÓŚ60”ę£»
£Ø4£©øł¾ŻŃõ»Æ»¹Ō·“Ó¦ÖŠµĆŹ§µē×ÓŹŲŗć£ŗn£ØMn3+£©”Į1=n£ØFe2+£©”Į1=0.02L”Į0.0500mol=1.00”Į10-3mol£¬øł¾ŻMnŌŖĖŲŹŲŗć£¬m£ØMnSO4•H2O£©=1.00”Į10-3mol”Į169g/mol=0.169g£¬ŅŌ“Ė¼ĘĖć“æ¶Č£®
½ā“š ½ā£ŗ£Ø1£©øł¾ŻMnO2+SO2=MnSO4æÉÖŖ£¬n£ØSO2£©=n£ØMnO2£©=$\frac{17.4g}{87g/mol}$=0.2mol£¬ĘäĢå»żĪŖ0.2mol”Į22.4L/mol=4.48L£¬
¹Ź“š°øĪŖ£ŗ4.48£»
£Ø2£©pH=7.1Ź±Mn£ØOH£©2æŖŹ¼³Įµķ£®ŹŅĪĀĻĀ£¬³żČ„MnSO4ČÜŅŗÖŠµÄFe3+”¢Al3+£¬ĒāŃõ»ÆĀĮĶźČ«±ä³É³ĮµķŹ±µÄpH£ŗKsp[Al£ØOH£©3]=1”Į10-33=c£ØAl3+£©”Įc3£ØOH-£©£¬c£ØAl3+£©=1”Į10-6mol•L-1£¬½āµĆ£ŗc£ØOH-£©=1”Į10-9mol•L-1£¬c£ØH+£©=1”Į10-5mol•L-1pH=5£¬Ķ¬ĄķFe£ØOH£©3ĶźČ«±ä³É³ĮµķŹ±£¬pHŌ¼ĪŖ3.5£¬¹ŹpH·¶Ī§ŹĒ£ŗ5.0£¼pH£¼7.1£¬¹Ź“š°øĪŖ£ŗ5.0£¼pH£¼7.1£»
£Ø3£©“ÓMnSO4ŗĶMgSO4»ģŗĻČÜŅŗÖŠ½į¾§MnSO4•H2O¾§Ģ壬øł¾ŻĶ¼ÉĻŠÅĻ¢£¬øßÓŚ60”ęŅŌŗóMnSO4•H2OµÄČܽā¶Č¼õŠ”£¬¶ųMgSO4•6H2OµÄČܽā¶ČŌö“ó£¬Ņņ“ĖæŲÖĘ½į¾§ĪĀ¶Č·¶Ī§ŹĒøßÓŚ60”ęÕāŃłæÉŅŌµĆµ½“æ¾»µÄMnSO4•H2O£¬¹Ź“š°øĪŖ£ŗøßÓŚ60”ę£»
£Ø4£©øł¾ŻŃõ»Æ»¹Ō·“Ó¦ÖŠµĆŹ§µē×ÓŹŲŗć£ŗn£ØMn3+£©”Į1=n£ØFe2+£©”Į1=0.02L”Į0.0500mol=1.00”Į10-3mol£¬øł¾ŻMnŌŖĖŲŹŲŗć£¬m£ØMnSO4•H2O£©=1.00”Į10-3mol”Į169g/mol=0.169g£¬“æ¶ČĪŖ$\frac{0.169g}{0.1710g}$”Į100%=98.8%£¬
“š£ŗMnSO4•H2OѳʷµÄ“æ¶ČĪŖ98.8%£®
µćĘĄ ±¾Ģāæ¼²é½Ļ×ŪŗĻ£¬Éę¼°Ńõ»Æ»¹Ō·“Ó¦¼ĘĖć”¢ČܶȻż¼ĘĖć¼°»ģŗĻĪļ·ÖĄė”¢Ķ¼Ļó·ÖĪöµČ£¬±¾ĢāĪŖ2015Äź½ĖÕøßæ¼Ģā18Ģā£¬×ŪŗĻŠŌ½ĻĒ棬²ąÖŲ·ÖĪö”¢¼ĘĖćÄÜĮ¦µÄ×ŪŗĻ漲飬ĢāÄæÄѶČÖŠµČ£®


 ŗ®¼ŁĢģµŲÖŲĒģ³ö°ęÉēĻµĮŠ“š°ø
ŗ®¼ŁĢģµŲÖŲĒģ³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | °“ĻµĶ³ĆüĆū·Ø£¬»ÆŗĻĪļ µÄĆū³ĘĪŖ£ŗ2£¬6-¶ž¼×»ł-5-ŅŅ»łøżĶé µÄĆū³ĘĪŖ£ŗ2£¬6-¶ž¼×»ł-5-ŅŅ»łøżĶé | |
| B£® | ±ū°±ĖįŗĶ±½±ū°±ĖįĶŃĖ®£¬×ī¶ąæÉÉś³É3ÖÖ¶žėÄ | |
| C£® | “óĘųĪŪČ¾Īļ·śĄū°ŗ-12µÄ»ÆѧŹ½ŹĒCF2Cl2¾ßÓŠÕżĖÄĆęĢå½į¹¹ | |
| D£® | ČżĻõĖįøŹÓĶõ„µÄ·Ö×ÓŹ½ĪŖC3H5N3O9 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| ·“Ó¦Ź±¼ä/min | n£ØCO£©/mol | n£ØH2O£©/mol | n£ØCO2£©/mol | n£ØH2£©/mol |
| 0 | 1.20 | 0.60 | 0 | 0 |
| t1 | 0.80 | |||
| t2 | 0.20 |
| A£® | ·“Ó¦ŌŚt1minÄ©µÄĖŁĀŹĪŖv£ØH2£©=0.2/t mol•L-1•min-1 | |
| B£® | Ę½ŗāŹ±Ė®ÕōĘųµÄ×Ŗ»ÆĀŹĪŖ66.67% | |
| C£® | øĆĪĀ¶ČĻĀ·“Ó¦µÄĘ½ŗā³£ŹżĪŖl | |
| D£® | ĘäĖūĢõ¼ž²»±ä£¬ČōĘšŹ¼Ź±£¬n£ØCO£©=0.60 mol£¬n£ØH2O£©=1.20 mol£¬ŌņĘ½ŗāŹ±Ė®ÕōĘųµÄ×Ŗ»ÆĀŹĪŖ33.33% |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | ÓĆĪļÖŹ A ±ķŹ¾µÄ·“Ó¦µÄĘ½¾łĖŁĀŹĪŖ 0.3 mol•L-1•s-1 | |
| B£® | ÓĆĪļÖŹ B ±ķŹ¾µÄ·“Ó¦µÄĘ½¾łĖŁĀŹĪŖ 0.6 mol•L-1•s-1 | |
| C£® | 2 s Ź±ĪļÖŹ A µÄ×Ŗ»ÆĀŹĪŖ70% | |
| D£® | 2 s Ź±ĪļÖŹ B µÄÅضČĪŖ 0.7 mol•L-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | K1=$\frac{[{H}_{2}]^{4}}{[{H}_{2}O]^{4}}$ | |
| B£® | Ōö“óc£ØH2O£©»ņ¼õŠ”c£ØH2£©£¬»įŹ¹Ę½ŗā³£ŹżK1¼õŠ” | |
| C£® | øı䷓ӦµÄĪĀ¶Č£¬Ę½ŗā³£ŹżK1²»Ņ»¶Ø±ä»Æ | |
| D£® | Fe3O4£Øs£©+4H2£Øg£©?3Fe£Øs£©+4H2O£Øg£©µÄĘ½ŗā³£ŹżĪŖK2£¬K1”ĮK2=1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĪķŠ¼ÓŚ½ŗĢ壬ÄܲśÉś¶”“ļ¶ūĻÖĻó | |
| B£® | “óĪķµÄŠĪ³ÉÓėĘū³µµÄĪ²ĘųÅÅ·Åƻӊ¹ŲĻµ | |
| C£® | ³ÖŠų“óĪķĢģĘųøųÅ©ŅµÉś²ś”¢½»ĶØŌĖŹäµČ“ųĄ“ŗÜ“óµÄÓ°Ļģ | |
| D£® | æÕĘųÖŠŠüø”µÄĻøŠ”æÅĮ£ĪļŃĻÖŲĪ£ŗ¦ČĖĢå½”æµ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | $\frac{200a}{m}$mol-1 | B£® | $\frac{200m}{a}$mol-1 | C£® | $\frac{2m}{a}$mol-1 | D£® | $\frac{2a}{m}$mol-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ·ÖÉ¢ĻµÖŠ·ÖÉ¢ÖŹĮ£×ÓµÄÖ±¾¶£ŗFe£ØOH£©3Šü×ĒŅŗ£¾Fe£ØOH£©3½ŗĢ壾FeCl3ČÜŅŗ | |
| B£® | ŃęÉ«·“Ó¦ŹĒĪļÖŹČ¼ÉÕŹ±»šŃę³ŹĻÖµÄŃÕÉ«±ä»Æ£¬ŹōÓŚ»Æѧ±ä»Æ | |
| C£® | øÖĢś·¢Éśµē»ÆѧøÆŹ“Ź±£¬øŗ¼«µÄµē¼«·“Ó¦Ź½ĪŖ Fe-3e-=Fe3+ | |
| D£® | µē½ā¾«Į¶ĶŹ±£¬Ńō¼«ÄąÖŠŗ¬ÓŠZn”¢Fe”¢Ag”¢AuµČ½šŹō |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com