

���� ʪ���������̿���Ҫ�ɷ�ΪMnO2��������Fe��Al��Mg������Ԫ�أ��Ʊ��ߴ�̼���̣�����Ũ�����ֲ��۽������˵õ���Һ��ȥ���ʣ�����̼������γɳ���ͨ��һϵ�в����õ��ߴ�̼���̣�
��1�����½��趼���Լӿ����ʵ��ܽⷴӦ���ʣ�����ֲ�����һ�ֻ�ԭ����
��2��ʹ��̼���̵�pH�������Dz������µ����ʣ���������������������Ϊ��������������ԭΪ�����ӣ�
��3������̼����������ֽ��������30�桫35���£���̼�������Һ�μӵ������̾���Һ�У����Ʒ�ӦҺ������pH��6.5��7.0���õ�MnCO3����������泥�������̼��ˮ�����ɵ�MnCO3�����辭���ϴ�ӣ�����ϴ���Ƿ���ȫ�ķ�����ȡ���һ��ϴ��Һ�����Ƿ��������������ƣ�
��4��Ksp ��MnCO3��=c��Mn2+��•c��CO32-������Mn2+������ȫʱ��c��CO32-��=1.8��10-11/1.0��10-5=1.8��10-6 mol•L-1����Mg2+Ҳ���γɳ�������Ҫ��Mg2+��2.6��10-5/1.8��10-6=14.4 mol•L-1��Mg2+��Ũ��0.01mol/LԶС��14.4 mol•L-1��
��� �⣺��1�����¡����趼���Լӿ����ʵ��ܽⷴӦ���ʣ�����ʱ�¶ȿ�����90�桫95��֮�䣬����Ҫ��������3Сʱ��Ŀ����������̿����̵Ľ����ʣ�����ֲ�����һ�ֻ�ԭ����
�ʴ�Ϊ��������̿����̵Ľ����ʣ�����ԭ����
��2��ʹ��̼���̵�pH�������Dz������µ����ʣ�������Һ�ж�������������������Ϊ��������������ԭΪ�����ӣ���Ӧ�����ӷ���ʽΪ��MnO2+H2O2+2H+=Mn2++2H2O+O2����
�ʴ�Ϊ������MnCO3�IJ������������µ����ʵȣ��� MnO2+H2O2+2H+=Mn2++2H2O+O2����
��3������̼����������ֽ�������¶ȿ���35�����µ�ԭ���Ƿ�ֹ̼����立ֽ⣬��30�桫35���£���̼�������Һ�μӵ������̾���Һ�У����Ʒ�ӦҺ������pH��6.5��7.0���õ�MnCO3����������泥�������̼��ˮ����Ӧ�Ļ�ѧ����ʽΪ��MnSO4+2NH4HCO3 $\frac{\underline{\;30-35��\;}}{\;}$MnCO3+��NH4��2SO4+CO2��+H2O�����ɵ�MnCO3�����辭���ϴ�ӣ�����ϴ���Ƿ���ȫ�ķ�����ȡ���һ��ϴ��Һ�����Ƿ��������������ƣ�ȡ���һ�ε�ϴ����Һ1��2 mL ���Թ��У������еμ��������ữ��BaCl2��Һ�����ް�ɫ�����������������ϴ�Ӹɾ���
�ʴ�Ϊ������̼����淋ķֽ⣬���ԭ�������ʣ�MnSO4+2NH4HCO3 $\frac{\underline{\;30-35��\;}}{\;}$MnCO3+��NH4��2SO4+CO2��+H2O��ȡ���һ�ε�ϴ����Һ1��2 mL ���Թ��У������еμ��������ữ��BaCl2��Һ�����ް�ɫ�����������������ϴ�Ӹɾ���
��4��Ksp ��MnCO3��=c��Mn2+��•c��CO32-������Mn2+������ȫʱ��c��CO32-��=$\frac{1.8��1{0}^{-11}}{1.0}$��10-5=1.8��10-6 mol•L-1����Mg2+Ҳ���γɳ�������Ҫ��Mg2+��2.6��10-5/1.8��10-6=14.4 mol•L-1��Mg2+��Ũ��0.01mol/LԶС��14.4 mol•L-1��������Һ�е�c��Mg2+��=10-2mol/L��˵��Mg2+�Ĵ��ڲ���Ӱ��MnCO3�Ĵ��ȣ�
��Ksp ��MnCO3��=c��Mn2+��•c��CO32-������Mn2+������ȫʱ��c��CO32-��=$\frac{1.8��1{0}^{-11}}{1.0}$��10-5=1.8��10-6 mol•L-1����Mg2+Ҳ���γɳ�������Ҫ��Mg2+��2.6��10-5/1.8��10-6=14.4 mol•L-1��Mg2+��Ũ��0.01mol/LԶС��14.4 mol•L-1��������Һ�е�c��Mg2+��=10-2mol/L��˵��Mg2+�Ĵ��ڲ���Ӱ��MnCO3�Ĵ��ȣ�
���� ���⿼����������ᴿ���ۺ�Ӧ�ã�Ϊ��Ƶ���㣬�������̷������������뷽���������ķ�ӦΪ���Ĺؼ������ط�����ʵ�������Ŀ��飬��Ŀ�Ѷ��еȣ�


 �����ÿ�ʱѵ��ϵ�д�
�����ÿ�ʱѵ��ϵ�д� ��Ԫȫ��������ϵ�д�
��Ԫȫ��������ϵ�д� �»ƸԱ����ܾ�ϵ�д�
�»ƸԱ����ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
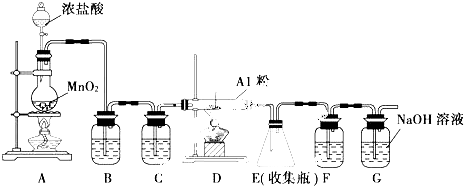
 ������Ҵ���Ӧ��װ����ͼ��ʾ�����Թ������3mL�Ҵ���Ȼ��һ�߽�����һ�������ؼ���2mLŨ�����2mL�����ᣬ�þƾ���С�ľ��ȵؼ���10min����������������������ͨ�뵽С�Թ�����Һ��Һ���ϣ�
������Ҵ���Ӧ��װ����ͼ��ʾ�����Թ������3mL�Ҵ���Ȼ��һ�߽�����һ�������ؼ���2mLŨ�����2mL�����ᣬ�þƾ���С�ľ��ȵؼ���10min����������������������ͨ�뵽С�Թ�����Һ��Һ���ϣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ������ | Fe��OH��3 | Fe��OH��2 | Co��OH��2 | Al��OH��3 | Mn��OH��2 |
| ��ʼ���� | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| ��ȫ���� | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
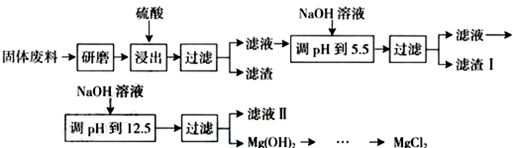
| ������ | Fe3+ | Al3+ | Mg2+ |
| pH | 3.2 | 5.2 | 12.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ʹ��ϡ��Һ | B�� | ѡ����ʵĴ��� | ||
| C�� | ��ϸ���巴Ӧ�� | D�� | ��߷�Ӧ��ϵ���¶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com