
��ҵ�Ͽ����á���������ת������������������ӦΪ��CH4(g)+H2O(g)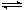 CO(g)+3H2(g)��
CO(g)+3H2(g)��
��֪�¶ȡ�ѹǿ��ˮ̼��[n(H2O)/ n(CH4)]�Լ���ƽ�⺬����%����Ӱ������ͼ1��
 |
ͼ1��ˮ̼��Ϊ3�� ͼ2��800�棩
��1��CH4(g)+H2O(g)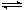 CO(g)+3H2(g)���ġ�H_______0 (�>����<��)�����ں��¡���ѹʱ�����ƽ����ϵ��ͨ�뺤��ƽ�⽫ �ƶ��������Ӧ���������淴Ӧ����������
CO(g)+3H2(g)���ġ�H_______0 (�>����<��)�����ں��¡���ѹʱ�����ƽ����ϵ��ͨ�뺤��ƽ�⽫ �ƶ��������Ӧ���������淴Ӧ����������
��2���¶ȶԸ÷�Ӧ�ķ�Ӧ���ʺ�ƽ���ƶ���Ӱ����
��
��3�������������䣬����ͼ2�л���ѹǿΪ2 MPaʱ������ƽ�⺬����%����ˮ̼��֮���ϵ���ߡ���ֻҪ�����µı仯���ߣ�
��4����֪����700�棬1MPaʱ��1mol CH4��1mol H2O��2L���ܱ������з�Ӧ��6���Ӵﵽƽ�⣬��ʱCH4��ת����Ϊ80%������6����H2��ƽ����Ӧ���ʺ��¶��·�Ӧ��ƽ�ⳣ���Ƕ��٣���д��������̣��������С�����һλ���֡���
��1������1�֣�������Ӧ����1�֣�
��2�������������䣬�����¶ȣ���Ӧ���ʼӿ죬ƽ��������Ӧ�����ƶ��������������µı仯����2�֣�
��3������ͼ��2�֣�����״1�֣���ע1�֣�
��4���������Ϊ��������ʽ��ʽ2�֣�����1�֣���������ʽ1�֣���1�֣���5�֣�
CH4(g)+H2O(g)  CO(g)+3H2(g)
CO(g)+3H2(g)
��ʼŨ�ȣ�mol/L��: 0.5 0.5 0 0
�仯Ũ�ȣ�mol/L��:0.4 0.4 0.4 1.2
ƽ��Ũ�ȣ�mol/L��:0.1 0.1 0.4 1.2
 (1��)
(1��)
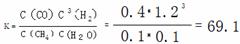 (2��)��ƽ�ⳣ��ûд��λ���۷֣�
(2��)��ƽ�ⳣ��ûд��λ���۷֣�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������и��⣺
(1)ǰ������Ԫ���У���̬ԭ����δ�ɶԵ���������������������ͬ��Ԫ����________�֡�
(2)�ڢ�A����A��Ԫ����ɵ� ������GaN��GaP��GaAs�����˹��ϳɵ����Ͱ뵼����ϣ��侧��ṹ�뵥�������ơ�Gaԭ�ӵĵ����Ų�ʽΪ______________����GaN�����У�ÿ��Gaԭ����__________��Nԭ����������ͬһ��Gaԭ��������Nԭ�ӹ��ɵĿռ乹��Ϊ________�����Ĵ��������У�GaN����_______���塣
������GaN��GaP��GaAs�����˹��ϳɵ����Ͱ뵼����ϣ��侧��ṹ�뵥�������ơ�Gaԭ�ӵĵ����Ų�ʽΪ______________����GaN�����У�ÿ��Gaԭ����__________��Nԭ����������ͬһ��Gaԭ��������Nԭ�ӹ��ɵĿռ乹��Ϊ________�����Ĵ��������У�GaN����_______���塣
(3)�ڼ��Է���NCl3�У�Nԭ�ӵĻ��ϼ�Ϊ-3,Clԭ�ӵĻ��ϼ�Ϊ+1,���Ʋ�NCl3ˮ�����Ҫ������_________(�ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʵ�����������ͽ��۾���ȷ����
| ѡ�� | ʵ����� | ���� | ���� |
| A | �����﴿��������ͨ��װ��ʪ��ĺ�ɫֽ�����Լ�ƿ�� | ��ɫ��ȥ | ������Ư���� |
| B | ���Ҵ��м�������Ũ�����Ʊ���ϩ����������������ֱ��ͨ������KMnO4��Һ�� | ����KMnO4��Һ�Ϻ�ɫ��ȥ | ֤����ϩ�ܱ����Ը���������� |
| C | ȡ����BaSO4�������Թ��У��������������� | �������ܽ� | BaSO4���������ᣬ�ҿ����������BaCl2��Һ����SO42�� |
| D | �ڷ�Һ©���м����ˮ���ټ���CCl4������� | �ֲ㣬���ϲ���Һ����ɫ | CCl4����Ϊ�����ȡ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ����
A����ҵ�õ������AlCl3�ķ����ƽ�����
B��Ǧ���ع���ʱ��������ӦΪ: PbO2 + 2e�� + 4H+ + SO42�� = PbSO4 + 2H2O
C����ⱥ��ʳ��ˮʱ��������������Cl�� ����������Ӧ
D����⾫��ͭʱ���������к���Zn��Fe��Ag��Au�Ƚ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��Ӧ2SO2(g) + O2(g) 2SO3(g) ��H����198kJ��mol-1����ij����㶨���ܱ������г���1mol SO2��0.5molO2����һ�������·�����Ӧ����ͼ��ij��������Y����ʱ�䣨t���仯��ʾ��ͼ������˵����ȷ����
2SO3(g) ��H����198kJ��mol-1����ij����㶨���ܱ������г���1mol SO2��0.5molO2����һ�������·�����Ӧ����ͼ��ij��������Y����ʱ�䣨t���仯��ʾ��ͼ������˵����ȷ����
A���¶�T2��T1
B����Ӧ�ﵽƽ���ų�99 kJ������
C��Y������SO2��ת���ʻ�SO3��Ũ��
D����Ӧ�ﵽƽ���������������ܶȼ�С
 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������(K2FeO4)��һ�����͡���Ч�����ˮ������������ˮ�����ӷ�Ӧ��4FeO42����10H2O===4Fe(OH)3(����)��3O2����8OH������ҵ�����Ƶø������ƣ�Ȼ���ڵ����£������������Һ�м���һ������KOH�Ϳ��Ƶø�����ء��Ʊ��������Ƶ����ַ�������Ҫ��Ӧԭ�����£�
ʪ���Ʊ���2Fe(OH)3��3ClO����4OH��===2FeO42����3Cl����5H2O��
�ɷ��Ʊ���2FeSO4��6Na2O2===2Na2FeO4��2Na2O��2Na2SO4��O2����
�����й�˵���д������
A�����������ˮ��Ӧʱ��ˮ����������Ӧ
B���ɷ���ÿ����1 mol Na2FeO4��ת��4 mol����
C��ʪ����ÿ����1 mol Na2FeO4��ת��3 mol����
D��K2FeO4����ˮʱ��������ɱ������ʹ�������ʳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�й�Al��NaOH��Һ��Ӧ��˵���У���ȷ����
A�����ǻ�ԭ�����仹ԭ������Al(OH)3
B��NaOH�����������仹ԭ������H2
C�����ǻ�ԭ����H2O��NaOH����������
D��H2O����������Al������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Fe(OH)3�����У���μ���HIϡ��Һ�������һϵ�б仯��
��1���ȳ��ֺ�ɫ������ԭ���� ��
��2���������ܽ⣬��Һ�ʻ�ɫ���˷�Ӧ�����ӷ���ʽ�� ��
��3�������Һ��ɫ����˷�Ӧ�����ӷ���ʽ�� ��
��4������ϡ�������HIϡ��Һ���ܳ���������Щ��ͬ�ı仯������д���������ţ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1200��ʱ����Ȼ���������лᷢ�����з�Ӧ
H2S��g��+ O2(g)=SO2(g)+H2O(g) ��H1
2H2S(g)+SO2(g)=S2 (g)+2H2O(g) ��H2
H2S(g)+O2(g)=S(g)+H2O(g) ��H3
2S(g) =S2(g) ��H4
���H4����ȷ����ʽΪ
A.��H4=����H1+��H2-3��H3�� B.��H4=��3��H3-��H1-��H2��
C.��H4=����H1+��H2-3��H3�� D.��H4= ����H1-��H2-3��H3��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com