
【题目】下列气态氢化物中 ,最稳定的是
A.PH3B.NH3C.H2OD.H2S
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】1999年曾报导合成和分离了含高能量的正离子N5+ 的化合物N5AsF6,下列说法正确的是( )
A. 其中只含有共价键,是共价化合物B. 其中只含有离子键,是离子化合物
C. 其中既有离子键,又有共价键,是离子化合物D. 以上说法都不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q kJ |
下列说法中,不正确的是( )
A. 容器①中反应达平衡时,CO的转化率为80%
B. 容器①中CO的转化率等于容器②中CO2的转化率
C. 平衡时,两容器中CO2的浓度相等
D. 容器①时CO的反应速率等于H2O的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有 A、B、C三种元素,其中 A、C两元素能形成化合物 AC。已知 B和 C原子的核外电子层数相同,且最外层电子数之和为10,A2+和B原子具有相同的电子层数。C原子最外层电子数为次外层电子数的3倍,请回答以下问题:
(1)A、B、C三种元素的名称分别是:A________、B________、C_______。
(2)写出 A离子的结构示意图__________。
(3)化合物 AC中存在的化学键为_______键,写出 AC 的电子式____________。
(4)写出化合物BC2的结构式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 合成氨工业选择的反应条件不是室温,是500℃左右
B. 配制氯化铁溶液时,将氯化铁加入盐酸中,然后加水稀释
C. 实验室常用排饱和食盐水的方法收集氯气
D. 硫酸工业中,使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述正确的是

A. lmol该有机物在镍催化下可消耗3molH2
B. 该有机物既能发生氧化反应又能发生还原反应
C. 该有机物的分子式为C12H18O2
D. 1mol该有机物能消耗2 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。完成下列填空:
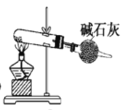

(1)A中加入NH4Cl与Ca(OH)2固体,写出加热时发生反应的化学方程式___;将制得氨气与氯化氢气体通入乙装置中,瓶内可以观察到的现象是____。
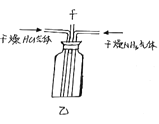
(2)丙为吸收尾气,乙装置的导管f连接的装置可以是____(填字母)。
a.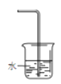 b.
b. c.
c.
(3)向丙装置中加入浓氨水,通入空气,同时将加热的铂丝插入锥形瓶内,能使铂丝保持红热的原因是___。锥形瓶中不可能生成的物质是____(可多选)。
A.H2 B.NO2 C.HNO3 D.NH4NO3
(4)反应结束后锥形瓶内的溶液中含由H+、OH-、___、___离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)常温下为无色液体,是应用广泛的化工原料和前景乐观的燃料。
(1)①己知:CO、H2、CH3OH的燃烧热(△H)分别为﹣283.0 kJmol-1、﹣285.8 kJmol-1、-726.8 kJmol-1,则CO和H2反应生成CH3OH的热化学方程式是________________。
②有人设想综合利用太阳能将天然气转化为较易存运的甲醇,装置如下图,装置工作时阳极反应方程式为_________________________________。

(2)一定温度下反应CO(g)+2H2(g)=CH3OH(g)在容积为2L的密闭容器中进行,其相关数据见上图。
①从反应开始至平衡时,用H2表示化学反应速率为__________,该温度下此反应的平衡常数为__________;
②5min后速率变化加剧的原因可能是___________________________;
(3)在6.98MPa、250℃和催化剂(CoI2)作用下,甲醇可转化为乙酸:
CH3OH(g) + CO(g) = CH3COOH(g)
有机合成常有副反应存在。若反应釜中CH3OH和CO配料比(质量)为1,甲醇生成乙酸的选择率为90.0%,则此反应CO的转化率为___________。
(4)常温Ka(CH3COOH)=1.8×10-5, 0.1 molL-1CH3COOH溶液中滴加0.1 molL-1CH3COONa溶液至 pH=7,此时混合溶液中两溶质的物质的量比n(CH3COOH):n(CH3COONa)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是( )
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 向橙色K2Cr2O7溶液中加入一定浓度的NaOH溶液后,溶液变为黄色
C. 对2 HI(g)![]() H2(g) + I2(g)平衡体系增大压强使气体颜色变深
H2(g) + I2(g)平衡体系增大压强使气体颜色变深
D. 溴水中有下列平衡Br2 + H2O![]() HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com