
| A、CH4-8e-+8OH-=CO2+6H2O |
| B、O2+4H++4e-=2H2O |
| C、CH4+10OH--8e-=C32-+7H2O |
| D、O2+2H2O+4e-=4OH- |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
| A、取代-加成-消去-氧化 |
| B、取代-消去-加成-消去 |
| C、取代-取代-消去-加成 |
| D、氧化-取代-消去-加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸,纯碱,明矾,二氧化硫 |
| B、盐酸,熟石灰,苛性钠,石灰水 |
| C、冰醋酸,乙醇,碳酸钠,氨水 |
| D、硝酸,烧碱,碳酸钙,氯化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1的醋酸中加入水或加入冰醋酸均可使平衡向电离方向移动 |
| B、等pH的醋酸和碳酸,分别加水稀释后溶液的pH仍相等,则醋酸中加入水的体积少 |
| C、等物质的量浓度的CH3COONa和Na2CO3溶液,后者溶液中水的电离程度大 |
| D、常温下10ml 0.02 mol?L-1HCl溶液与10ml 0.02 mol?L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20ml,则溶液的pH=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

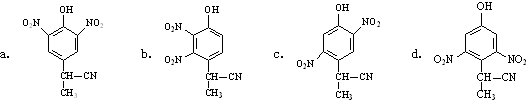
 为原料制备
为原料制备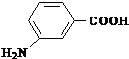 的合成路线流程图(无机试剂任选).合成路线流程图示例如图:CH2=CH2
的合成路线流程图(无机试剂任选).合成路线流程图示例如图:CH2=CH2| HBr |
| 催化剂,△ |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下Ksp(Ag2CrO4)=1.1×10-12,Ksp(AgCl)=1.8×10-10,则Ag2CrO4的溶解度小于AgCl |
| B、纯碱溶于热水中,去油污效果增强,说明纯碱的水解是放热反应 |
| C、为保护海轮的船壳,常在船壳上镶入锌块 |
| D、以熔融Al2O3为电解质进行电解冶炼铝,熔融体中Al3+向阳极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:2- 4 |
| H+ |
| 转化 |
2- 7 |
| Fe2+ |
| 还原 |
| CH- |
| 沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、四份溶液中水的电离程度由大到小的顺序为:①=②=④<③ |
| B、若将②、③等体积混合,则混合液的pH为7 |
| C、将四份溶液稀释相同倍数后,溶液的pH:③>④>②>① |
| D、若在10mL①中加入④至pH刚好等于7,则C(Na+)=C(CH3COO-),混合溶液总体积<20mL(假设混和溶液体积为酸和碱溶液体积之和) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com