
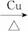
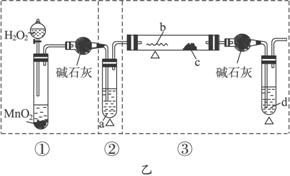
(1)简述三套方案各自的优点。
(2)集中各套方案的优点组成一套比较合理完善的实验装置,可按气流由左至右的顺序表示为____________(例如甲①,乙②,丙③)。
(3)若要保证此实验有较高的效率,还需补充的仪器有____________,理由是___________________________。
(4)实验中能验证乙醇氧化产物的实验现象是____________。
(5)装置中,若撤去第①部分,其他操作不变,则无水硫酸铜无明显变化,其余现象与(4)相同,推断硬质玻璃管中主要反应的化学方程式是____________________________________。
解析:本题以乙醇的氧化实验为基础,综合考查了对不同实验方案的评价以及设计基本实验方案的能力,同时还考查了根据实验现象进行观察、分析并得出正确结论的能力。
本题考查乙醇氧化的实验并要求验证其产物,其中产物中的水用无水硫酸铜来验证,产物中的乙醛用新制的氢氧化铜悬浊液来验证,为了防止氢氧化铜悬浊液中的水与无水硫酸铜反应,应在二者之间连接一个干燥管。本实验中所需的氧气应是干燥的,避免干扰对产物中水的验证。为了得到较平稳的乙醇气流,应用水浴加热,且水浴温度应控制在78 ℃或略高于78 ℃,以减少其挥发,提高反应效率。
答案:(1)甲:②中用水浴加热,可形成较平稳的乙醇气流,使反应更充分。
乙:①与③中的干燥管可防止溶液中的水与无水硫酸铜反应,避免干扰对生成物水的验证。
丙:①中氧气发生装置中无水生成,且装置简单。
(2)丙①甲②乙③
(3)温度计 控制水浴温度在78 ℃或略高于78 ℃,使乙醇蒸气平稳流出,减少其挥发,提高反应效率
(4)c处无水硫酸铜变蓝,d处生成红色沉淀
(5)C2H5OH![]() CH3CHO+H2↑
CH3CHO+H2↑


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:阅读理解


 [AgI2]-
[AgI2]-查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
请回答下列问题:?
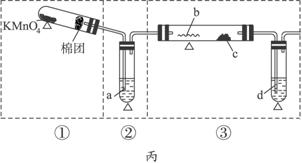
(1)铁屑表面少量的铁锈(主要成分为Fe2O3·aH2O)对制取硫酸亚铁有无影响 (填“有”或“无”)。其原因是: 。如有影响将如何操作? (若无影响,此问可以不答)。
(2)FeSO4在不同温度下的溶解度如下表所示:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
溶解度/g | 18.5 | 20.8 | 26.3 | 32.8 | 40.1 | 48.4 | 52.4 | 50.9 | 43.7 |
由于废铁屑含有C、Si等杂质,为了使FeSO4溶液的浓度增大,便于反应后分离溶液和残渣,该小组实验时采取了水浴加热和趁热过滤的方法。这样做的主要目的是为了防止 。你认为实验时的水浴温度最好控制在 ℃?左右。??
(3)测定晶体中结晶水含量所用的实验仪器除托盘天平(或物理天平)、研钵、坩埚、坩埚钳、三脚架、泥三角、酒精灯、药匙外,还有 ;判断晶体中结晶水完全失去的实验操作是 。?
(4)计算硫酸亚铁晶体化学式中x的实验值表达式为x= ?。(已知:硫酸亚铁晶体中结晶水的质量为m g、硫酸亚铁晶体的质量为w g)?
(5)由于铁屑或铁丝与硫酸反应速率慢,实验过程中有的同学提出采用电解的方法,可以加快制取FeSO4溶液的反应速率,该方法的电解质溶液是 ,阳极的电极反应方程式为: 。?
请你再写出一种(不包括改变温度和硫酸的浓度)以铁单质为反应物,能加快制取FeSO4溶液反应速率的方法: 。?
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学课外活动小组为了探究不同催化剂对氧化氢分解速率的影响,设计并进行了如下实验,请你完成下列各项任务。
I.氧化铜的制备。
(1)称取10g胆矾,将其放入小烧杯中,再溶于适量水配成溶液。
(2)向步骤(1)中的烧杯内滴加NaOH溶液,直至产生大量的沉淀。
(3)检验沉淀是否完全,其操作方法是 。
(4)将步骤(2)所得混合物加热至沉淀全部变为黑色。
(5)再将步骤(4)所得混合物 、洗涤、 后研细。本步骤中要验证是否洗净硫酸根离子的方法是: 。
II.比较不同催化剂对过氧化氢分解速率的影响。
该课外活动小组拟完成的实验及实验记录的表格如下,
拟采用下图所示装置来测定氧气的体积。

| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| ① | 15mL | 无 | |
| ② | 15mL | CuO(0.5g) | |
| ③ | 15mL | MnO2(0.5g) |
试回答下列问题:
(1)本实验中影响双氧水分解速率的因素有:①实验时的温度和压强;②双氧水的浓度
③不同的催化剂;④ ;⑤ 等。
(2)上述实验中的“待测数据”可以是 ;也可以是 。
(3)为探究CuO在实验②中是否起催化作用,除与①比较外,还需补做下列实验(不必写具体操作):①证明CuO的化学性质没有改变;② 。
(4)你认为可以使过氧化氢分解的催化剂还有 (填一种物质的化学式或名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
①称量CuSO4·5H2Om1g,在研钵中研细后,完全溶于适量水中;
②向盛硫酸铜溶液的烧杯内加入稍过量的NaOH溶液,使Cu2+完全沉淀;
③将烧杯内的悬浊液转移到蒸发皿中,小火加热至沸,搅拌,直到沉淀完全变为黑色;
④冷却后,过滤,并用蒸馏水洗涤沉淀2—3次;
⑤将固体充分干燥后,称量得CuO m2g,研细备用。
请回答:
(1)本实验多次用到玻璃棒,其作用分别为步骤①___________,步骤③___________,步骤④___________。
(2)步骤②中证明NaOH已足量的方法是_________________。
(3)步骤④中洗涤沉淀的操作为_________________,目的是___________________。
Ⅱ.该小组用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:
2 NH3+3CuO![]() N2+3Cu+3H2O
N2+3Cu+3H2O
请回答:
(1)如果选用测定生成物Cu和H2O的质量m(Cu)、m(H2O)时,请用下列仪器设计一个简单的实验方案。

①仪器连接的顺序(用字母编号表示,仪器可重复使用)_____________;d的作用是___________;b中试剂X的名称是___________。
②列出计算Cu的相对原子质量的表达式___________。
(2)①如果仍采用上述仪器装置,测定下列物理量也可以达到实验目的的有___________。
A.m(CuO)和m(H2O) B.V(N2)和m(CuO)
C.m(NH3)和m(H2O) D.m(CuO)和m(Cu)
②若可以增加仪器装置,为达到实验目的,上述A、B、C、D还可以选择___________;完成此选择的实验,应该增加的仪器是___________(选择装置代号)。

查看答案和解析>>
科目:高中化学 来源:2011年四川省成都市双流县高考化学模拟试卷(解析版) 题型:解答题
 [AgI2]-
[AgI2]-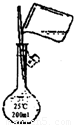
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com