
生产、生活中处处有化学,下列有关说法正确的是
A.工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料
B.某雨水样品放置一段时间后,PH由4.68变为4.00,是因为水中溶解的CO2增多
C.在结冰的路面上撒盐,是利用盐与水发生化学反应放出大量热量,促使冰雪融化
D.人类对于能源的利用大致可以分为三个时代:柴草能源、化石能源、多能源时代,目前,全球已主要处于多能源时代
科目:高中化学 来源:2015-2016学年湖北武汉华中师大一附高一下期中化学试卷(解析版) 题型:填空题
下表为元素周期表的一部分,已列出10种元素在周期表中的位置。按要求回答下列问题。
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
第2周期 | ⑦ | ⑧ | ||||||
第3周期 | ① | ③ | ⑤ | ④ | ⑨ | ⑩ | ||
第4周期 | ② | ⑥ |
(1)10种元素中,形成气态氢化物最稳定的是 元素(填元素符号)。
(2)⑥的最高价的氧化物与氢氧化钠反应的化学方程式为____________________。
(3)等电子的①③⑤⑦四种元素形成的离子,离子半径由大到小的顺序是(填离子符号)________>________>________>________。
(4)④、⑦元素形成的氢化物中,沸点较高的是_____,理由是_______。
(5)用一个实验事实(或一个化学方程式)证明④、⑨元素的非金属性更强的是⑨:______。
(6)用电子式表示③⑧形成化合物的过程 _________________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北沙市高二下第四次半月考化学试卷(解析版) 题型:选择题
下面的排序正确的是( )
A.硬度由大到小:金刚石>碳化硅>晶体硅 B.熔点由高到低:SiC>Si>SiO2>Ge
C.沸点由高到低:NH3>PH3>AsH3>SbH3 D.晶格能由大到小:NaI>NaBr>NaCl>NaF
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三5月高考模拟理综化学试卷(解析版) 题型:实验题
【化学–选修5:有机化学基础】
有机物G是某种新型药物的中间体,其合成路线如下:
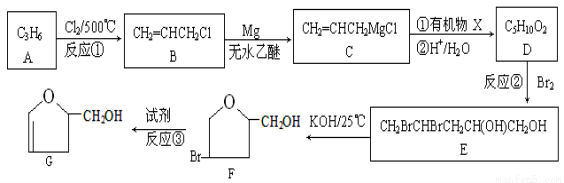
已知: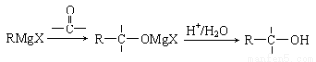
回答下列问题:
(1)写出反应③所需要的试剂 ;反应①的反应类型是 。
(2)有机物B中所含官能团的名称是 ;
(3)写出有机物X的结构简式 ;
(4)写出由E到F的化学方程式 ;
(5)写出所有同时符合下列条件的D的同分异构体的结构简式 ;
①能发生银镜反应; ②能发生水解反应
(6)以1-丙醇为原料可合成丙三醇,请设计合成路线(无机试剂及溶剂任选)。
已知:烯烃上的烷烃基在500℃与氯气发生取代反应。
注:合成路线的书写格式参照如下示例流程图:
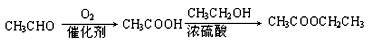
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三5月高考模拟理综化学试卷(解析版) 题型:选择题
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是

A.镍是阳极,电极反应为4OH--4e一= O2↑+ 2 H2O
B.电解时电流的方向为:负极→Ni电极→溶液→Fe电极→正极
C.若隔膜为阴离子交换膜,则OH-自右向左移动
D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三考训练四理综化学试卷(解析版) 题型:选择题
U、V、W、X为四种短周期元素,有关这四种元素的说法中一定正确的是 ( )
元素 | U | V | W | X |
原子半径(nm) | 0.077 | 0.075 | 0.102 | 0.099 |
最高正价或最低负价 | +4 | +5 | -2 | -1 |
A.V的氢化物与X的氢化物反应的产物只含有共价键
B.1molX的单质参加氧化还原反应时转移的电子数为1.204×1024
C.U与W形成UW2时各原子均满足8电子稳定结构
D.0.3molCu分别与足量HVO3和H2WO4的稀溶液反应均产生0.2mol气体
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都七中高一下课后作业乙烯化学试卷(解析版) 题型:实验题
1,2-二溴乙烷在常温下是无色液体,密度是2.18g/cm3,沸点是131.4℃,熔点是9.79℃,不溶于水,易溶于醇、丙酮等有机溶剂.在实验室可用如图所示装置来制备1,2-二溴乙烷.其中试管c中装有浓溴水.
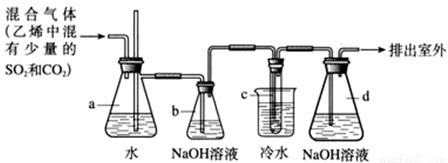
(1)写出制备1,2-二溴乙烷的化学方程式:_____________________。
(2)安全瓶a可以防止倒吸,并可以检查实验进行时试管c是否发生堵塞。如果发生堵塞,a中的现象是:______.
(3)容器b中NaOH溶液的作用是______,相应的离子方程式为________________,可能发生反应的离子方程式为__________________________。
(4)将试管c置于冷水中,以及液溴表面覆盖少量水的原因是:____________。
(5)某同学在做实验时,使用一定量的液溴,当溴全部褪色时,通入的乙烯混合气体的量比正常情况下超出许多。如果装置的气密性没有问题,试分析可能的原因:__________。
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三第二轮限时训练四化学试卷(解析版) 题型:实验题
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫以及铁的化合物。
Ⅰ.近年来,湿法炼铜有了新进展,某工厂以一种叫Thibacillus ferroxidans的细菌为基体生产铜和绿矾的工艺流程如下:
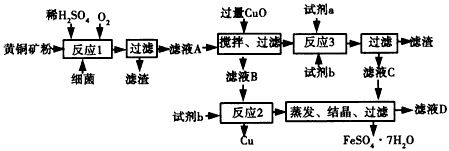
(1)试剂a为________,试剂b为_______(写名称)。
(2)反应1的化学方程式为 。
Ⅱ.以CuFeS2精矿为原料在沸腾炉中和O2(空气)反应,生成物冷却后经溶解、除铁、结晶,得到CuSO4·5H2O。沸腾炉的温度与生成物主要成分的水溶性和酸溶性实验结果如图。
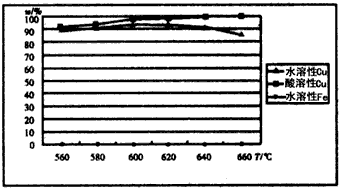
(3)沸腾炉生成物中的含铁物质主要成分为___________。
(4)为获得最高的水溶性Cu(%),沸腾炉的温度应控制在______ ℃左右,高于该温度生成物中的水溶性Cu(%)下降,可能原因是_____________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一下期中化学试卷(解析版) 题型:选择题
某气态烃0.5 mol能与1 mol HCl完全加成,加成后产物分子上的氢原子又可被3 mol Cl2取代,则此气态烃可能是( )
A.CH≡CH B.CH2=CH2 C. CH≡C-CH3 D.CH2=C(CH3)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com