
| A. | 活化分子间的碰撞一定是有效碰撞 | |
| B. | 对于任何化学反应,增大压强均可使单位体积内活化分子数增多,反应速率加快 | |
| C. | 加入反应物,可增加活化分子百分数,从而增大化学反应速率 | |
| D. | 某反应的△H=100kJ•mol-1,说明正反应活化能比逆反应活化能大100kJ•mol-1 |
分析 A、只有发生化学反应的活化分子的碰撞才是有效碰撞;
B、只有有气体参加或生成的反应,增大压强才能使单位体积内活化分子数增多,反应速率加快;
C、反应物为纯固体或液体时,加入该反应物,反应速率不变;
D、焓变与活化能的关系是△H=正反应的活化能-逆反应的活化能.
解答 解:A、活化分子间的碰撞不一定是有效碰撞,只有发生化学反应的活化分子的碰撞才是有效碰撞,故A错误;
B、只有有气体参加或生成的反应,增大压强可使单位体积内活化分子数增多,反应速率加快,故B错误;
C、反应物为纯固体或液体时,加入该反应物,反应速率不变,故C错误;
D、某反应的△H=100kJ•mol-1,则正反应的活化能-逆反应的活化能=100kJ•mol-1,即正反应活化能比逆反应活化能大100 kJ•mol-1,故D正确;
故选D.
点评 本题考查影响化学反应速率的因素,把握温度、浓度、压强、催化剂对反应速率的影响即可解答,注意活化能、活化分子对反应速率的影响,题目难度不大.


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、Fe2+、NO3- | B. | Fe3+、Fe2+、SO42-、NO3- | ||
| C. | Na+、OH-、SO42-、H2PO4- | D. | Al3+、Na+、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

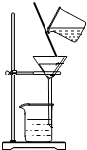
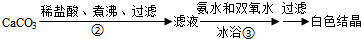
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
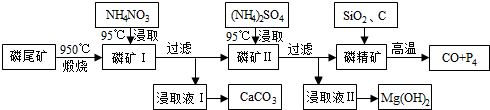
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、OH-、NO3- | B. | Ba2+、H+、SO42- | C. | K+、OH-、CO32- | D. | Fe3+、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 《神农本草经》记载,麻黄能“止咳逆上气” | 碳酸氢钠药片 |  |  |
| 古代中国人已用麻黄治疗咳嗽 | 该药是抗酸药,服用时喝些醋能提高药效 | 看到有该标志的丢弃物,应远离并报警 | 贴有该标志的物品是可回收物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com