
分析 (1)可加入碳酸钠溶液,过滤后再加入适量盐酸;
(2)利用水和有机溶剂互不相溶,放出少量液体,加入液体根据是否分层来判断.
解答 解:(1)硫酸钡不溶于水,氯化钙可与碳酸钠反应生成碳酸钙沉淀,过量碳酸钠可加入盐酸除去,蒸发可得到氯化钠,操作方法为把固体溶于水,充分溶解后,加入过量的碳酸钠后过滤,在滤液中加入适量盐酸,蒸干即可,
答:把固体溶于水,充分溶解后,加入过量的碳酸钠后过滤,在滤液中加入适量盐酸,蒸干即可;
(2)利用水和有机溶剂互不相溶,设计判断方法,操作步骤为:取一支小试管,打开分液漏斗的活塞,慢慢放出少量液体,往其中加入少量水,如果加水后,试管中的液体不分层,说明分液漏斗中,下层是“水层”,如果液体分层,则上层是水层.
答:取少量下层液体于试管中,加入少量水,如不分层,则下层是水,反之上层是水.
点评 本题综合考查物质的分离、提纯以及检验的实验设计,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及操作方法,难度不大.


科目:高中化学 来源: 题型:多选题
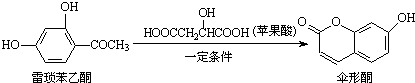
| A. | 雷琐苯乙酮所有碳原子不可能共平面 | |
| B. | 雷琐苯乙酮和伞形酮都能跟FeCl3溶液发生显色反应 | |
| C. | 1 mol雷琐苯乙酮跟足量H2反应,最多消耗3 mol H2 | |
| D. | 1 mol伞形酮与足量NaOH溶液反应,最多消耗3 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(SO32-)>c(OH-)>c(HSO3-) | B. | c(OH-)=c(HSO3-)+2c(H2SO3)+c(H+) | ||
| C. | 加入少量NaOH固体,Kw增大 | D. | 加入稀盐酸,c(HSO3-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色、易挥发,有刺激性气味的液体 | |
| B. | 浓度为98%以上的浓硝酸叫发烟硝酸,具有脱水性 | |
| C. | 浓硝酸通常显黄色,因为溶解了少量的二氧化氮 | |
| D. | 硝酸不稳定,浓度越大越易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素单质的颜色按Cl2、Br2、I2的顺序逐渐变深 | |
| B. | Cl2、Br2、I2的氧化性逐渐增强 | |
| C. | 氯、溴、碘的原子半径或离子半径随电子层数的增多而增大 | |
| D. | 氯气易液化,溴单质易挥发,碘单质易升华 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
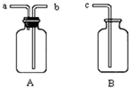 如图所示用一起A、B和胶管组成装置收集NO气体(仪器A已经气密性检查;除水外不能选用其他试剂)正确的操作步骤是:在A中加满水,盖紧瓶塞,用胶管连接b和c接口,由a导入NO气体,水通过b和c排入B中.
如图所示用一起A、B和胶管组成装置收集NO气体(仪器A已经气密性检查;除水外不能选用其他试剂)正确的操作步骤是:在A中加满水,盖紧瓶塞,用胶管连接b和c接口,由a导入NO气体,水通过b和c排入B中.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com