
【题目】![]() 是一种有机合成的中间体,可以通过以下途径来合成:
是一种有机合成的中间体,可以通过以下途径来合成:

已知:(1) 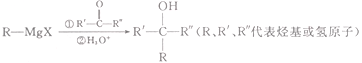
(2) 
(3) ![]()
回答下列问题:
(1)M的分子式为__________________。
(2)N的系统命名法的名称为_____________________。
(3)D中官能团名称为__________________。
(4)由A生成B的化学方程式为___________________。反应类型为________________。
(5)H是比G少6个碳原子的G的同系物,则H有_________种,其中核磁共振氢谱有三组吸收峰的结构简式为___________________。
(6)写出用氯苯为原料制备化合物 的合成路线:______________________。(其他试剂任选)。
的合成路线:______________________。(其他试剂任选)。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】设C+CO22CO﹣Q1 , 反应速率v1;N2+3H22NH3+Q2反应速率v2 . 对于上述反应,当温度升高时,v1和v2的变化情况为( )
A.同时增大
B.同时减小
C.v1增大,v2减小
D.v1减小,v2增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学在实验室用加热1-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如图所示装置,其中夹持仪器、加热仪器及冷却水管没有画出。
已知①NaBr+H2SO4=NaHSO4+HBr
②CH3(CH2)2CH2OH+HBr![]() CH3(CH2)2CH2Br+H2O
CH3(CH2)2CH2Br+H2O
两反应都需加热
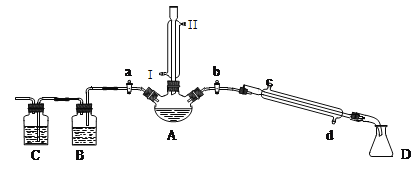
请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。竖直冷凝管接通冷凝水,出水口是_____(填“I”或“Ⅱ”);冷凝回流的主要目的是________。
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等。熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物B、C中应盛放的试剂分别是石蕊和溴水,B装置除用石蕊还可用______(填试剂名称)写出C装置中主要的化学方程式:_________________________________________________。
有同学拟通过红外光谱仪鉴定所得产物中是否含有“-CH2CH2CH2CH3”, 来确定副产物中存在丁醚。请你对该同学的观点进行评价________________________________。
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
物质 | 熔点/℃ | 沸点/℃ |
1-丁醇 | -89.5 | 117.3 |
1-溴丁烷 | -112.4 | 101.6 |
丁醚 | -95.3 | 142.4 |
1-丁烯 | -185.3 | -6.5 |
请你补充下列实验步骤,直到分离出1-溴丁烷。
①待烧瓶冷却后,拔去竖直的冷凝管;
②插上带橡皮塞的温度计;
③关闭_______,打开_______;
④接通冷凝管的冷凝水,使冷水从______处流入;
⑤迅速升高温度至_______℃,收集所得馏分。
(4)若实验中所取1-丁醇、NaBr分别为7.4 g、13.0 g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到10.96 g 1-溴丁烷,则1-溴丁烷的产率是_____。(保留2位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以1-氯丙烷为主要原料制1,2-丙二醇(CH3—CHOH—CH2OH)时,需要经过的反应依次为( )
A. 加成、消去、取代 B. 取代、加成、消去
C. 取代、消去、加成 D. 消去、加成、取代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是
A. 2g D218O中所含中子数为NA
B. 2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA
C. 1mol/L碳酸氢钠溶液中的HCO3—数目小于NA
D. 一定条件下,39g的乙炔和苯的气体混合物中所含原子总数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10 mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg![]() 的变化如图所示。下列叙述正确的是
的变化如图所示。下列叙述正确的是
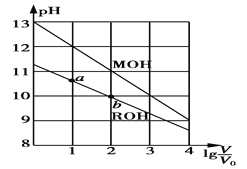
A. MOH为弱碱,ROH为强碱
B. ROH的电离程度:a点大于b点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当lg![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关海水综合利用的说法正确的是( )
A.海水晒盐后的母液中,直接加入CCl4可萃取Br2单质
B.从海水制海盐主要是通过化学变化完成
C.电解氯化钠溶液可以制得钠单质和氯气
D.电解熔融的氯化镁可制备镁单质和氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍是重要的合金元素,可制作镍铬、镍铝等合金,镍也常用作有机加氢的催化剂及制取配合物。
(1)写出基态Cr的简化电子排布式__________,Cr中共有__________种不同能级的电子。
(2)Ni(CO)n与Fe(CO)5同属金属羰基配合物,形成配合物时,每个CO提供一对电子与金属原子形成配位键,研究发现金属原子的价电子和CO提供的电子总和等于18。
①Ni、C、O的电负性由大到小的顺序为____________________。
② Ni(CO)n分子中n=__________。
③已知Ni2+和Fe2+的离子半径分别为69pm和78pm,根据岩浆晶出规则熔融的NiO和FeO岩浆在冷却过程中,NiO更容易先结晶,试解释其原因____________________。
(3)检定镍、钴、铜钯等可用双氰胺,化学式C2H4N4,其结构简式如图所示。双氰胺分子中碳原子的杂化方式有__________,分子结构中键能最大的共价键是__________。
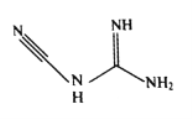
(4)镍的晶体结构、镍铝合金的晶胞如图所示。
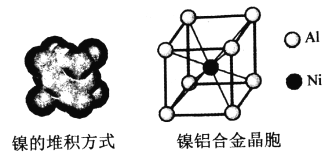
①镍晶体的堆积方式为__________。
②已知Al的第一、第二电离能分别为:l1=578kJ/mol,l2=1817kJ/mol,简述l2远大于l1的原因__________________________________________________。
③已知:镍铝合金密度为dg/cm3,NA代表阿伏伽德罗常数,则铝镍的核间距为__________ pm。(用代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com