
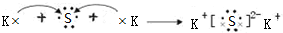 ,其化合物中化学键的类型是离子键.
,其化合物中化学键的类型是离子键. 分析 X、Y、Z三种元素的离子都和氩原子具有相同的电子层排布.X元素单质能在氢气中燃烧,产生苍白色火焰,X为Cl;Y元素氢化物的分子式是H2Y,最低价为-2价,其最高氧化物YO3中含有40%的Y,则设Y的相对原子质量为n,则$\frac{n}{n+48}$×100%=40%,解得n=32,即Y为S;Z元素的离子具有紫色的焰色反应,则Z为K,然后结合元素化合物知识来解答.
解答 解:X、Y、Z三种元素的离子都和氩原子具有相同的电子层排布.X元素单质能在氢气中燃烧,产生苍白色火焰,X为Cl;Y元素氢化物的分子式是H2Y,最低价为-2价,其最高氧化物YO3中含有40%的Y,则设Y的相对原子质量为n,则$\frac{n}{n+48}$×100%=40%,解得n=32,即Y为S;Z元素的离子具有紫色的焰色反应,则Z为K,
(1)由上述分析可知,X、Y、Z分别为氯、硫、钾,故答案为:氯;硫;钾;
(2)非金属性越强,对应最高价含氧酸的酸性越强,则X、Y、Z最高价氧化物对应的水化物的酸性由强到弱的顺序是HClO4>H2SO4>KOH,
故答案为:HClO4>H2SO4>KOH;
(3)用电子式表示Z2Y的形成过程为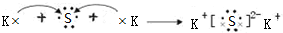 ,只含离子键,
,只含离子键,
故答案为: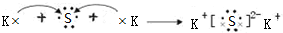 ;离子键.
;离子键.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素化合物性质等为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识及规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 混合气体颜色不再变化 | |
| B. | 单位时间内生成nmol氢气的同时生成nmol碘蒸气 | |
| C. | 若该反应在隔热密闭体积恒定的容器中进行反应,体系的温度不再变化 | |
| D. | 2v正(H2)=v逆(HI) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
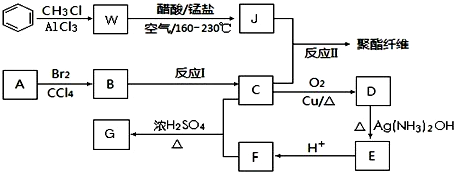
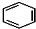 +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$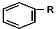 +HCl(-R为烃基)
+HCl(-R为烃基)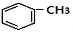 $→_{空气/160-230℃}^{醋酸/锰盐}$
$→_{空气/160-230℃}^{醋酸/锰盐}$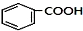
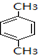 .
.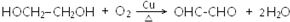 .
.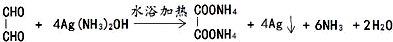 .
.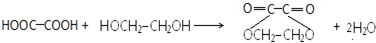 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硫酸共热并保持70-80℃反应生成苯磺酸 | |
| B. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | |
| D. | 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 化学反应的速率和限度均可通过改变化学反应条件而改变 | |
| C. | 可逆反应只是代表少数反应 | |
| D. | 化学反应达到平衡状态时,正反应速率与逆反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是第5周期元素 | |
| B. | 原子核内一定有82个中子 | |
| C. | 铈的四种同位素形成的中性原子,核外电子数相同 | |
| D. | Ce2+中有55个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 利用所学化学知识解答问题:
利用所学化学知识解答问题:查看答案和解析>>
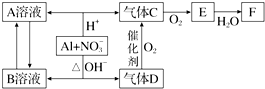
科目:高中化学 来源: 题型:推断题
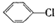 制备
制备 步骤:
步骤: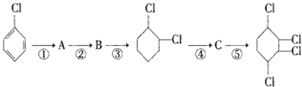
 ,B
,B ,C
,C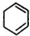
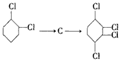 的化学方程式①
的化学方程式①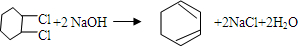 ②
②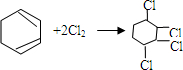 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com