
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
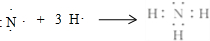 .
.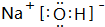 ,在该化合物中既含有离子键,又含有共价键.
,在该化合物中既含有离子键,又含有共价键. 分析 由元素在周期表中位置,可知①为H、②为He、③为C、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为S、⑩为Cl.
(1)其原子只要形成一对共用电子对就达到了稳定结构是H、F、Cl;
(2)①和④号元素形成的化合物为NH3,属于共价化合物,用N原子、H原子电子式表示其形成过程;
(3)⑧号元素的最高价氧化物的水化物为氢氧化镁;
(4)①、⑤、⑦号元素形成的一种化合物为NaOH,由钠离子与氢氧根离子构成,该化合物中含有离子键、共价键.
解答 解:由元素在周期表中位置,可知①为H、②为He、③为C、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为S、⑩为Cl.
(1)H原子核外有1个电子,可以形成1对共用电子对形成2电子稳定结构,F、Cl原子最外层有7个电子,形成1对共用电子对形成8电子稳定结构,
故答案为:H、F、Cl;
(2)①和④号元素形成的化合物为NH3,属于共价化合物,用电子式表示其形成过程为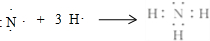 ,
,
故答案为:NH3;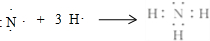 ;
;
(3)⑧号元素的最高价氧化物的水化物为氢氧化镁,化学式为Mg(OH)2,
故答案为:Mg(OH)2;
(4)①、⑤、⑦号元素形成的一种化合物为NaOH,由钠离子与氢氧根离子构成,电子式为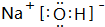 ,该化合物中含有离子键、共价键,
,该化合物中含有离子键、共价键,
故答案为: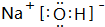 ;离子、共价.
;离子、共价.
点评 本题考查元素周期表、电子式、化学键等,难度不大,熟练掌握短周期元素,掌握用电子式表示化学键或物质形成过程.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
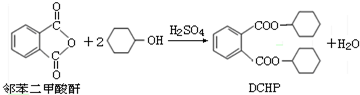
| A. | 邻苯二甲酸酐的二氯代物有2种 | |
| B. | 环己醇分子中所有的原子可能共平面 | |
| C. | DCHP能发生加成反应、取代反应、消去反应 | |
| D. | 1molDCHP可与氢氧化钠溶液反应,最多可消耗2molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃可保存在带玻璃塞的玻璃瓶中 | |
| B. | 钠保存在煤油中 | |
| C. | 液氯可以保存钢瓶中 | |
| D. | 过氧化钠、漂白粉要密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某有机物的结构简式如下所示,则下列关于该有机化合物的各项叙述正确的是( )
某有机物的结构简式如下所示,则下列关于该有机化合物的各项叙述正确的是( )| A. | 该有机物遇氯化铁溶液不呈紫色 | |
| B. | 1mol该有机物能与6mol氢氧化钠反应 | |
| C. | 该有机物能与6mol金属钠反应生成6molH2 | |
| D. | 在稀硫酸存在下可以发生水解反应,但水解的产物只有一种有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
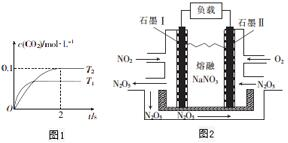 汽车尾气和燃煤尾气是造成空气污染的原因之一.
汽车尾气和燃煤尾气是造成空气污染的原因之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强可提高反应速率 | |
| B. | 升高温度可减小反应速率 | |
| C. | 若反应物的总能量比生成物的总能量低,说明该反应是放热反应 | |
| D. | 增大氧气的浓度可使NO2转化率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、NO3- | |
| B. | pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-12mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| D. | 所含溶质为Na2SO4的溶液:K+、HCO3-、NO3-、Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com