
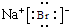 .
. .
.分析 有A、B、C、D、E、F、G七种主族元素,A、B、C是同一周期的金属元素,原子核外有3个电子层,处于第三周期,A的原子半径在所属周期中最大且原子半径A>B>C,则A为Na、B为Mg、C为Al;D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,二者元素最低负化合价为-1,二者都处于ⅦA族,在室温时,D的单质是液体,E的单质是固体,则D为Br、E为I;F的单质在常温下是气体,性质很稳定,则F为N元素;G是除氢外原子半径最小的元素,则G为F元素,据此解答.
解答 解:有A、B、C、D、E、F、G七种主族元素,A、B、C是同一周期的金属元素,原子核外有3个电子层,处于第三周期,A的原子半径在所属周期中最大且原子半径A>B>C,则A为Na、B为Mg、C为Al;D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,二者元素最低负化合价为-1,二者都处于ⅦA族,在室温时,D的单质是液体,E的单质是固体,则D为Br、E为I;F的单质在常温下是气体,性质很稳定,则F为N元素;G是除氢外原子半径最小的元素,则G为F元素,
(1)属于同主族的元素为F、Br、I,钠与溴形成的化合物溴化钠的电子式为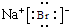 ,故答案为:F、Br、I;
,故答案为:F、Br、I;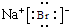 ;
;
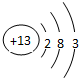
(2)B为镁,元素位于周期表中第三周期第ⅡA族,C为铝,原子的结构示意图为: ,
,
故答案为:三周期ⅡA族; ;
;
(3)F为氦,故答案为:氦;
(4)Na元素的金属性最强,所以碱性最强的NaOH,F没有最高价含氧酸,其它元素中酸性最强的为HBrO4,F元素非金属性最强,故HF最稳定,故答案为:NaOH;HBrO4;HF;
(5)C的氧化物对应的水化物为氢氧化铝,A的氧化物对应水化物为NaOH,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,故答案为:Al(OH)3+NaOH=NaAlO2+2H2O.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,题目比较基础,需要学生全面掌握基础知识.


科目:高中化学 来源: 题型:实验题
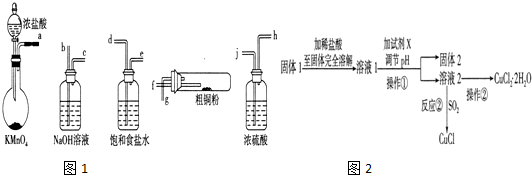
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
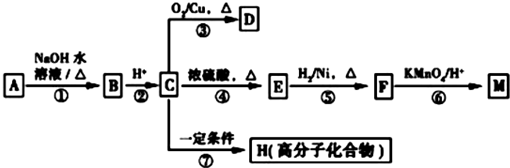
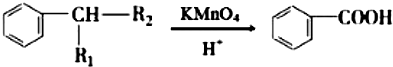 (R1、R2表示烃基或氢原子)
(R1、R2表示烃基或氢原子) .
.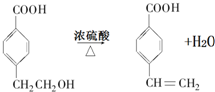 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤⑥ | C. | ②③⑤⑥⑦ | D. | ①②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)有两种气体单质Am和Bn.已知7.2g Am和6.3g Bn所含的原子个数相同,分子个数之比却为2:3.又知A原子中L电子层含电子数是K电子层的3倍.通过计算回答:写出B的元素名称氮
(1)有两种气体单质Am和Bn.已知7.2g Am和6.3g Bn所含的原子个数相同,分子个数之比却为2:3.又知A原子中L电子层含电子数是K电子层的3倍.通过计算回答:写出B的元素名称氮查看答案和解析>>
科目:高中化学 来源: 题型:解答题
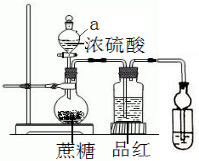 在烧瓶放20克蔗糖,依次加入少量水、20mL浓硫酸,蔗糖逐渐变黑,体积膨胀,形成疏松多孔的黑面包,烧瓶发烫,品红溶液颜色变淡.请回答:
在烧瓶放20克蔗糖,依次加入少量水、20mL浓硫酸,蔗糖逐渐变黑,体积膨胀,形成疏松多孔的黑面包,烧瓶发烫,品红溶液颜色变淡.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com