
| A. | ④⑤⑥⑧ | B. | ④⑤⑦⑧ | C. | ③④⑤⑧ | D. | ③④⑤⑦⑧ |
分析 既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色,则有机物含碳碳双键、碳碳三键、-CHO、酚-OH等,以此来解答.
解答 解:①乙酸与溴水、高锰酸钾均不反应,故不选;
②苯与溴水、高锰酸钾均不反应,故不选;
③聚乙烯不含碳碳双键,与溴水、高锰酸钾均不反应,故不选;
④苯酚含酚-OH,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色,故选;
⑤2-丁炔含碳碳三键,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色,故选;
⑥甲醛含-CHO,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色,故选;
⑦邻-二甲苯与溴水不反应,故不选;
⑧环己烯中含碳碳双键,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色,故选;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意常见有机物的性质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ②④⑤ | C. | ②③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石和SiO2 | B. | CO2和SiO2 | C. | NaCl和 HCl | D. | 钠和KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 已知前四周期六种元素A、B、C、D、E、F的核电荷数依次增大.B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成AC型离子化合物,其中的阴、阳离子相差一个电子层.E4+离子和氩原子的核外电子排布相同,F元素含量决定了人体内血红蛋白携氧能力的大小.请回答:
已知前四周期六种元素A、B、C、D、E、F的核电荷数依次增大.B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成AC型离子化合物,其中的阴、阳离子相差一个电子层.E4+离子和氩原子的核外电子排布相同,F元素含量决定了人体内血红蛋白携氧能力的大小.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<B | B. | 原子序数:A>B | ||
| C. | 原子最外层电子数:B>A | D. | 元素所在的周期数:A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
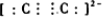 ,其中α键和π键数目之比为1:2.
,其中α键和π键数目之比为1:2.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a(A-N+3)}{A+3}$mol | B. | $\frac{a(A-N+8)}{A+16}$mol | ||
| C. | $\frac{a(2A-2N+40)}{2A+90}$mol | D. | $\frac{2A-2N+24}{2A+54}$mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com