
科目:高中化学 来源: 题型:选择题
| A. | 使用前要无需检验容量瓶是否漏液 | |
| B. | 用蒸馏水洗涤后必须要将容量瓶烘干 | |
| C. | 为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行 | |
| D. | 为了使所配溶液浓度均匀,定容结束后,要摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
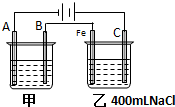 如图为相互串联的甲、乙两电解池试回答:
如图为相互串联的甲、乙两电解池试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先后滴加紫色石蕊试液、BaCl2溶液,可以将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 | |
| B. | 用加入过量CuCl2溶液,再过滤,除去Cu(NO3)2溶液中混有的AgNO3 | |
| C. | 向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42- | |
| D. | 某固体在加入稀盐酸产生了无色无味且能使澄清石灰水变浑浊的气体,证明该固体一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它的体积为2.24L | B. | 其摩尔体积为22.4L.mol-1 | ||
| C. | 含有氮分子数为0.4NA | D. | 其摩尔质量为28mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②③④ | C. | ①③⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 加入0.2mol的MnO2粉末于100mL过氧化氢的溶液中(密度为1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:
加入0.2mol的MnO2粉末于100mL过氧化氢的溶液中(密度为1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化氯(C1O2)气体是一种常用高效的自来水消毒剂.
二氧化氯(C1O2)气体是一种常用高效的自来水消毒剂.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com