

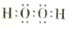 ;“溶解”后铜元素的主要存在形式是Cu2+(填离子符号).
;“溶解”后铜元素的主要存在形式是Cu2+(填离子符号).分析 铜锌合金加入过氧化氢和盐酸溶解煮沸赶出过量的过氧化氢,加入缓冲溶液“调PH”为了避免溶液的酸性太强,否则“滴定”时发生反应:S2O32-+2H+═S↓+SO2↑+H2O,加入足量KI溶液发生反应生成CuI,)“转化”步骤中,CuI转化为CuSCN,CuSCN吸附I2的倾向比CuI更小,使“滴定”误差减小,生成的I2用Na2S2O3标准溶液滴定,
根据消耗的Na2S2O3溶液体积可测算合金中铜的含量,
(1)过氧化氢为共价化合物,形成的是共价键,“溶解”后铜元素的主要存在形式是Cu2+;
(2)298K时,液态过氧化氢分解,每生成0.01molO2放出热量1.96kJ,标注物质聚集状态和对应反应的焓变书写热化学方程式;
(3)①缓冲溶液是浓度均为0.10mol/L的CH3COOH和CH3COONH4的混合溶液,溶液显酸性,醋酸根离子浓度大于铵根离子浓度;
②若100mL Na2S2O3溶液发生上述反应时,20s后生成的SO2比S多3.2g,结合反应S2O32-+2H+═S↓+SO2↑+H2O可知,反应的Na2S2O3 物质的量
0.1mol,反应速率v=$\frac{△c}{△t}$;
(4)“沉淀”步骤中有CuI沉淀产生是铜离子氧化碘离子生成CuI和碘单质;
(5)“转化”步骤中,CuI转化为CuSCN,CuSCN吸附I2的倾向比CuI更小,结合沉淀转化和溶度积常数计算;
(6)A.铁元素溶解后变化为Fe2+能和 Na2S2O3溶液反应;
B.I2和I-结合生成I3-使获得CuSCN减少;
C.CuSCN在空气中久置会发生潮解;
D.“滴定”过程中,往锥形瓶内加入少量蒸馏水对滴定实验无影响;
解答 解:(1)H2O2的电子式为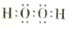 ,“溶解”后铜元素的主要存在形式是Cu2+,
,“溶解”后铜元素的主要存在形式是Cu2+,
故答案为: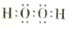 ;Cu2+;
;Cu2+;
(2)298K时,液态过氧化氢分解,每生成0.01molO2放出热量1.96kJ,生成1mol氧气放热196KJ,标注物质聚集状态和对应反应的焓变书写热化学方程式为:2H2O2(l)═O2(g)+2H2O(l)△H=-196 kJ/mol,
故答案为:2H2O2(l)═O2(g)+2H2O(l)△H=-196 kJ/mol;
(3)①缓冲溶液是浓度均为0.10mol/L的CH3COOH和CH3COONH4的混合溶液,溶液显酸性,醋酸根离子浓度大于铵根离子浓度,溶液中离子浓度大小为:c(CH3COO-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(CH3COO-)>c(NH4+)>c(H+)>c(OH-);
②若100mL Na2S2O3溶液发生上述反应时,20s后生成的SO2比S多3.2g,结合反应S2O32-+2H+═S↓+SO2↑+H2O可知,反应的Na2S2O3 物质的量
0.1mol,反应速率v=$\frac{△c}{△t}$=$\frac{\frac{0.1mol}{0.1L}}{20s}$=0.050mol/(L•s)
故答案为:0.050;
(4)“沉淀”步骤中有CuI沉淀产生是铜离子氧化碘离子生成CuI和碘单质,反应的离子方程式为:2Cu2++4I-═2CuI↓+I2 ,
故答案为:2Cu2++4I-═2CuI↓+I2;
(5)“转化”步骤中,CuI转化为CuSCN,CuSCN吸附I2的倾向比CuI更小,CuI+SCN-?CuSCN+I-,c(SCN -):c(I-)=$\frac{c(SC{N}^{-})c(C{u}^{2+})}{c({I}^{-})c(C{u}^{2+})}$=$\frac{Ksp(CuSCN)}{Ksp(CuI)}$=$\frac{4.4×1{0}^{-15}}{1.1×1{0}^{-12}}$=4.0×10-3
故答案为:4.0×10-3;
(6)A.铁元素溶解后变化为Fe2+能和 Na2S2O3溶液反应使测定结果偏高,故A正确;
B.I2和I-结合生成I3-使获得CuSCN减少,测定铜含量偏低,故B错误;
C.CuSCN在空气中久置会发生潮解,使测定铜含量偏高,故C正确;
D.“滴定”过程中,往锥形瓶内加入少量蒸馏水对滴定实验无影响,故D错误;
故答案为:A、C;
点评 本题考查了弱酸弱碱盐的酸碱性判断方法、滴定实验过程和误差分析、离子反应和离子浓度大小比较、氧化还原反应等知识点,掌握基础是解题关键,题目难度中等.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
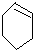 、B
、B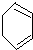 .
.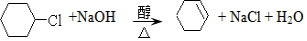 ,③
,③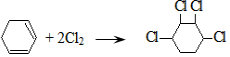 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
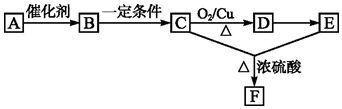
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10种 | B. | 11种 | C. | 12种 | D. | 15种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | HA | H2B |
| 电离平衡常数(25℃) | Ka=1.7×10-6 | K1=1.3×10-3 K2=5.6×10-8 |
| A. | 等物质的量浓度的各溶液pH关系为:PH(Na2B)>pH(NaHB)>pH(NaA) | |
| B. | 将a mol•L-1的HA溶液与a mol•L-1 的NaA溶液等体积混合,混合液中:c(Na+)>c(A-) | |
| C. | 向Na2B溶液中加入足量的HA溶液发生反应的离子方程式为:B2-+2HA═2A-+H2B | |
| D. | NaHB溶液中部分微粒浓度的大小为:c(Na+)>c(HB-)>c(B2- )>c(H2B) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
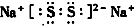 ;所含化学键类型离子键、非极性共价键.
;所含化学键类型离子键、非极性共价键.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
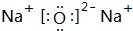 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com