
| A. | 常温常压下,22.4L的氧气中含氧原子数为2NA | |
| B. | 2L 0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 乙烯和环丙烷组成的28g混合气体中氢原子的个数为4NA | |
| D. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
分析 A、常温常压下,气体摩尔体积大于22.4L/mol;
B、1mol硫酸钾中含有1mol硫酸根离子,带有2mol负电荷;
C、乙烯和环丙烷的最简式均为CH2;
D、过氧化钠与水的反应为歧化反应.
解答 解:A、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L氧气的物质的量小于1mol,故含有的氧原子的个数小于2NA个,故A错误;
B、溶液中硫酸钾的物质的量n=CV=0.5mol/L×2L=1mol,而1 mol硫酸钾中阴离子硫酸根离子的物质的量为1mol,带有2mol负电荷,而溶液中还有水电离出的OH-,故溶液中阴离子所带电荷数大于2NA,故B错误;
C、乙烯和环丙烷的最简式均为CH2,故28g混合气体中含有的CH2的物质的量n=$\frac{28g}{14g/mol}$=2mol,故含有氢原子4mol即4NA个,故C正确;
D、过氧化钠与水的反应为歧化反应,当生成1mol氧气时转移2mol电子,故当生成0.1mol氧气时,转移0.2mol电子即0.2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{125a}{9V}$mol•L -1 | B. | $\frac{125a}{18V}$mol•L -1 | C. | $\frac{125a}{36V}$mol•L -1 | D. | $\frac{125a}{54V}$mol•L -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子的半径在10-9m~10-7m之间的分散系叫做胶体 | |
| B. | 少量金属钠可保存在煤油中 | |
| C. | CO2水溶液能导电,因此CO2是电解质 | |
| D. | 汤姆生、卢瑟福、玻尔等科学家对原子结构模型的提出作出了很大贡献 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③>④>①=② | B. | ②>①>④>③ | C. | ③>④>②>① | D. | ④>③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质(括号内为杂质) | 除去杂质的方法 |
| A | KCl(MnO2) | 加水溶解,过滤,洗涤,干燥 |
| B | FeSO4溶液(CuSO4) | 加入适量的锌粉,过滤 |
| C | NaCl溶液(CuCl2) | 加入过量的NaOH溶液,过滤 |
| D | O2(H2O) | 将混合气体通过盛有足量浓硫酸的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用丁达尔效应可以鉴别溶液和胶体 | |
| B. | 用分液漏斗分离碘与CCl4的混合液 | |
| C. | 某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中有Cl- | |
| D. | 某溶液中滴加NaOH溶液有蓝色沉淀,说明原溶液中有Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,铁与水蒸气反应生成8.96L H2时(已折合成标况),转移的电子数为0.8NA | |
| B. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 室温下,23gNO2和N2O4的混合气体中含有的N原子数目为0.75NA | |
| D. | 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
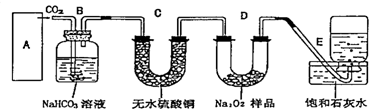
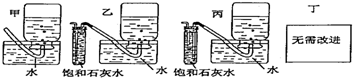
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com