

 4Ag+4H++O2↑(2分);0.112(2分)
4Ag+4H++O2↑(2分);0.112(2分) 4Ag+4H++O2↑。阴极增重2.16 g,即银的质量是2.16g,物质的量是2.16g÷108g/mol=0.02mol。所以根据方程式可知,生成氧气的物质的量=0.02mol÷4=0.005mol。因此在标准状况下的体积=0.005mol×22.4L/mol=0.112L。
4Ag+4H++O2↑。阴极增重2.16 g,即银的质量是2.16g,物质的量是2.16g÷108g/mol=0.02mol。所以根据方程式可知,生成氧气的物质的量=0.02mol÷4=0.005mol。因此在标准状况下的体积=0.005mol×22.4L/mol=0.112L。

 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源:不详 题型:填空题
 2SO3(g)
2SO3(g) 

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 4NO(g) △H=+292.3kJ·mol—1,
4NO(g) △H=+292.3kJ·mol—1, N2(g)+2CO2(g) 的△H= ;
N2(g)+2CO2(g) 的△H= ; 2N2O5(g);已知体系中n(NO2)随时间变化如下表:
2N2O5(g);已知体系中n(NO2)随时间变化如下表:| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):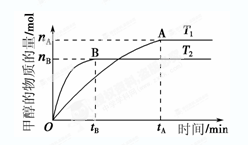
| A.温度为T1时,从反应开始到平衡,生成甲醇 的平均速率为v(CH3OH)=  mol·L-1·min-1 mol·L-1·min-1 |
| B.该反应在T1时的平衡常数比T2时的小 |
| C.该反应为放热反应 |
D.处于A点的反应体系从T1变到T2,达到平衡时 增大 增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-260.4 kJ·mol-1 | B.+260.4 kJ·mol-1 |
| C.-611.5 kJ·mol-1 | D.+520.8 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 4N2(g)+6H2O(g) (△H <0)
4N2(g)+6H2O(g) (△H <0) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g) 2N2O(g)+6H2O(g)
2N2O(g)+6H2O(g) 4N2O(g)+6H2O(g)
4N2O(g)+6H2O(g)
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 O2(g)=H2 O(g) △H=-241.8kJ·mol-1
O2(g)=H2 O(g) △H=-241.8kJ·mol-1 O2(g)=CO(g) △H=-110.5kJ·mol-1
O2(g)=CO(g) △H=-110.5kJ·mol-1 2NO(g) △H
2NO(g) △H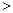 0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在1.0 L密闭容器内经过5s反应达到平衡,测得NO为8.0×10-4 mol。
0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在1.0 L密闭容器内经过5s反应达到平衡,测得NO为8.0×10-4 mol。 2CO2(g)+N2(g) 中,NO的浓度
2CO2(g)+N2(g) 中,NO的浓度
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 NCl3+3H2↑;假设NCl3中氮元素为+3价。
NCl3+3H2↑;假设NCl3中氮元素为+3价。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-F | 427 | C-Cl | 330 | C-I | 218 |
| H-H | 436 | S=S | 255 | H-S | 339 |
 H1=" +1175.7" kJ·mol-1
H1=" +1175.7" kJ·mol-1 H2= —771.1 kJ·mol-1
H2= —771.1 kJ·mol-1 H3=" +482.2" kJ·mol-1
H3=" +482.2" kJ·mol-1 H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com