
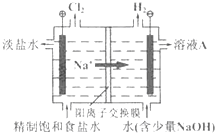
 �ȼҵ�Ե�⾫�Ʊ���ʳ��ˮ�ķ�����ȡ�������������ռ���ȵĺ������ε�ϵ�л�����Ʒ����ͼ�����ӽ���Ĥ�����ʳ��ˮ��ʾ��ͼ��ͼ�е����ӽ���Ĥֻ����������ͨ�������������գ�
�ȼҵ�Ե�⾫�Ʊ���ʳ��ˮ�ķ�����ȡ�������������ռ���ȵĺ������ε�ϵ�л�����Ʒ����ͼ�����ӽ���Ĥ�����ʳ��ˮ��ʾ��ͼ��ͼ�е����ӽ���Ĥֻ����������ͨ�������������գ����� ����ͼ֪����ⱥ��ʳ��ˮʱ���ұߵ缫����������������Һ��ˮ�õ�����������ͬʱ����NaOH������AΪNaOH��
��1���ö��Ե缫��ⱥ��ʳ��ˮʱ�������������ӷŵ�����������������ˮ�õ����������������������ӣ�
��2��AΪNaOH��
��3����������ˮ�������ᣬ������ˮ�ķ�Ӧ�ǿ��淴Ӧ�������������������ܽ⣻
��4�����ݷ�Ӧ�����������д����ʽ��
��5����ĵ���ƽ�ⳣ��Խ���������Ӧ���������ˮ��̶�ԽС����ͬŨ�ȵ�������ҺpHԽС��
��� �⣺����ͼ֪����ⱥ��ʳ��ˮʱ���ұߵ缫����������������Һ��ˮ�õ�����������ͬʱ����NaOH������AΪNaOH��
��1���ö��Ե缫��ⱥ��ʳ��ˮʱ�������������ӷŵ�����������������ˮ�õ����������������������ӣ���ط�ӦʽΪ2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$Cl2��+H2��+2OH-���ʴ�Ϊ��2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$Cl2��+H2��+2OH-��
��2��ͨ�����Ϸ���֪��AΪNaOH���ʴ�Ϊ��NaOH��
��3����������ˮ�������ᣬ������ˮ�ķ�Ӧ�ǿ��淴Ӧ�������������������ܽ⣬�������������ݳ����ʴ�Ϊ��Cl2��ˮ��Ӧ��Cl2+H2O?HCl+HClO������HCl��Ũ��ʹƽ�������ƶ�������Cl2��ˮ�е��ܽ⣬������Cl2���ݳ���
��4�����ݷ�Ӧ�����������д����ʽΪ2KClO3+H2C2O4+2H2SO4=2ClO2��+2CO2��+2KHSO4+2H2O���ʴ�Ϊ��2KClO3+H2C2O4+2H2SO4=2ClO2��+2CO2��+2KHSO4+2H2O��
��5����ĵ���ƽ�ⳣ��Խ���������Ӧ���������ˮ��̶�ԽС����ͬŨ�ȵ�������ҺpHԽС��
���ݵ���ƽ�ⳣ��֪������H2SO3��H2CO3��HSO3-��HClO��HCO3-�����������ˮ��̶�CO32-��ClO-��SO32-��HCO3-��HSO3-��.1mol/L NaClO��Һ��pH��0.1mol/L Na2SO3��Һ��pH���������ˮ��̶�Խ������Һ�и��������Ũ��ԽС����������Ũ�ȴ�С˳����c��SO32-����c��CO32-����c��HCO3-����c��HSO3-����
�ʴ�Ϊ�����ڣ�c��SO32-����c��CO32-����c��HCO3-����c��HSO3-����
���� ���⿼����ԭ����Ϊ��Ƶ���㣬�漰��⡢����Ũ�ȴ�С�Ƚϡ�������ԭ��Ӧ�����淴Ӧ��֪ʶ�㣬��ȷ��ѧ��Ӧԭ�������������ǽⱾ��ؼ���֪������ƽ�ⳣ����С���������ǿ�����������ˮ��̶���Դ�С��ϵ����Ŀ�ѶȲ���


 Ӣ�ŵ��ϵ�д�
Ӣ�ŵ��ϵ�д� ������������Ծ�ϵ�д�
������������Ծ�ϵ�д� �������Ӳ�ϵ�д�
�������Ӳ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
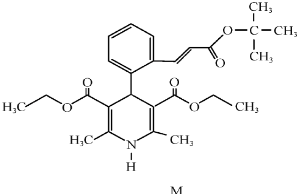
| A�� | ���ڷ����廯���� | B�� | ��FeCl3��Һ����ɫ | ||
| C�� | ����ʹ���Ը��������Һ��ɫ | D�� | 1molM��ȫˮ������2mol�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
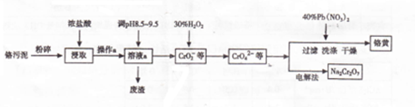
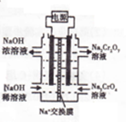
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HCl | B�� | CO2 | C�� | NH3 | D�� | CO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
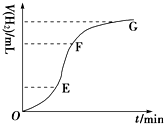 �����ô�����п����ϡ���ᷴӦ��ȡH2����ش�
�����ô�����п����ϡ���ᷴӦ��ȡH2����ش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ϡ��ˮ��ͨ�����CO2��NH3•H2O+CO2�TNH4++HCO3- | |
| B�� | ��NH4��2SO4��Һ�м�������Ba��OH��2��Ba2++SO42-=BaSO4�� | |
| C�� | ��ϡHNO3�ܽ�FeS���壺FeS+2H+�TFe2++H2S�� | |
| D�� | ����������Һ������ʵ�����ϡ�����ϣ�Ca2++OH-+H++SO42-�TCaSO4��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �뾶��Y2-��Z-��X+��W3+ | B�� | ��ԭ�ԣ�Y2-��Z- | ||
| C�� | �����ԣ�W3+��X+ | D�� | ��������c��d��b��a |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | a+2b-c | B�� | a+b-2c | C�� | 2a+2b-c | D�� | a+2b-2c |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com