
设NA为阿伏加德罗常数,下列说法中正确的是
A.10g 质量分数为46%的乙醇水溶液中所含氢原子数为0.6NA
B.将标准状况下22.4LNO与11.2LO2混合后的体积约为22.4L
C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为7NA
D.6g石英晶体中含有的Si-O键数为0.2NA
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源:2016届湖北省高三上学期12月月考理综化学试卷(解析版) 题型:推断题
[化学—选修5:有机化学基础]
有机物F是有机合成工业中一种重要的中间体。以甲苯和丙烯为起始原料合成F的工艺流程如下:

回答下列问题:
(1)化合物B中的含氧官能团名称是 F的结构简式
(2)写出C与银氨溶液共热的化学反应方程式:
(3)化合物D不能发生的反应有 (填序号)。
①加成反应 ②取代反应 ③消去反应 ④氧化反应 ⑤水解反应
(4)B的含苯环结构的同分异构体还有 种,其中一种的核磁共振氢谱中出现4个
峰且不与FeCl3溶液发生显色反应的是 (填结构简式)。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省大连市高三上12月月考理综化学试卷(解析版) 题型:填空题
Ⅰ、高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的
放电电压。高铁电池的总反应为
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
(1) 放电时正极附近溶液的碱性 (填增强、减小或不变);放电时每转移3 mol 电子,有 molK2FeO4被 (填氧化或还原)
(2)电池充电时阳极反应为
Ⅱ、下列框图中,A由两种黑色金属氧化物等物质的量混合而成,B中含有四种阳离子.据此回答下列问题:
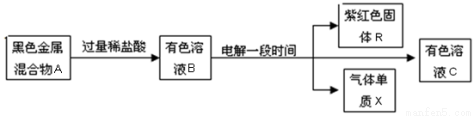
(1)A的组成是(填化学式)
(2)相同条件下,溶液B中所有阳离子的氧化性由强到弱的顺序依次是
(3)A中某组分可由单质与水反应制得,化学方程式为:
(4)电解所用装置如右图所示
电解开始阶段,阳极上的电极反应是
电解至阴极刚开始有固体R析出时,该溶液中金属离子浓度由大到小的顺序是

查看答案和解析>>
科目:高中化学 来源:2016届内蒙古赤峰二中高三上学期12月月考理综化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是( )
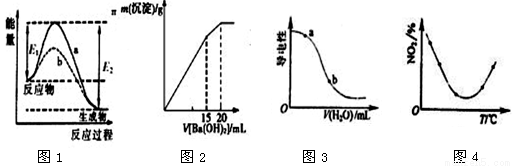
A.图1表示某放热反应在无催化剂(a)和有催化剂(b)时反应的能量变化,且加入催化剂改变反应的焓变
B.图2表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2溶液时铝离子恰好沉淀完全
C.图3表示在CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
D.图4表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:
2NO2(g)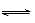 N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西柳州铁路第一中学高二上段考理化学卷(解析版) 题型:选择题
下列有关化学反应速率的说法正确的是
A.用铁片和稀硫酸反应制氢气时,可改用98%的浓硫酸加快生成氢气速率
B.100 mL 2 mol·L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
D. SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西桂林中学高二上期中考试理化学试卷(解析版) 题型:填空题
填空题。
(1)用以下五种物质的编号进行填空:①甲烷 ②苯 ③乙醇 ④蚁酸 ⑤淀粉 其中:
能发生银镜反应的是 ;燃烧时产生浓烟的是 ;分子结构是正四面体的是 ;
遇碘水显蓝色的是 ;工业上可用乙烯水化法制备得到的是 。
(2)按要求填空:
①葡萄糖的分子式 ; ②乙炔的电子式 ; ③2-甲基-1-戊烯的键线式 。
(3)写出下列反应的化学方程式:
①溴乙烷在氢氧化钠的醇溶液中共热 。
②乙酸乙酯在氢氧化钠的水溶液中共热 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东广州执信中学高一上期中考试化学试卷(解析版) 题型:选择题
下列有关0.2mol•L﹣1 BaCl2溶液的说法正确的是
A.1L溶液中Cl﹣离子浓度为0.2mol•L﹣1
B.1L溶液中Cl﹣离子总数为0.2NA
C.1L溶液中Ba2+离子浓度为0.2mol•L﹣1
D.1L溶液中Ba2+和Cl﹣离子总数为0.4NA
查看答案和解析>>
科目:高中化学 来源:2016届山西平遥中学等重点中学高三第三次练兵化学试卷(解析版) 题型:填空题
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓硝酸或浓硫酸反应生成二氧化硒以回收硒。完成下列填空:
(1) Se和浓硝酸反应的还原产物为一氧化氮和二氧化氮,且一氧化氮和二氧化氮的物质的量比为1:1,写出硒和浓硝酸的反应方程式 。
(2)已知:Se+2H2SO4(浓)→ 2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O → Se+2SO32-+4H+
SeO2、 H2SO4(浓)、 SO2的氧化性由强到弱的顺序是 。
(3)回收得到的二氧化硒的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O ②I2+2Na2S2O3 → Na2S4O6+2NaI配平方程式①,标出电子转移的方向和数目。
(4)实验中,准确称量二氧化硒样品0.1500g,消耗了0.2000mol/L的Na2S2O3溶液25.00mL,所测定的样品中二氧化硒的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com