
元素周期律是20世纪科学技术发展的重要理论依据之一。已知A、B、C、D、E五种元素都是元素周期表中前20号元素,A、B、C、D四种元素在元素周期表(长式)中的相对位置如下图所示,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水,E元素原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族。

根据以上信息,回答下列问题:
(1)上述五种元素中电负性最大的是________。(填相关元素的元素符号)
(2)请写出D的电子排布式:____________________________。
(3)A和D的氢化物中,沸点较高的是________(填相关物质的分子式);其原因是
____________________________________。
(4)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子位于该正方体的顶点或面心;阴离子均位于小正方体中心。该化合物的化学式为____________。

科目:高中化学 来源: 题型:
标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1 ,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是( )
A.ρ=(17V+22 400)/(22.4+22.4V)
B.w=17c/(1 000ρ)
C.w=17V/(17V+22 400)
D.c=1 000Vρ/(17V+22 400)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.分子间作用力是分子间相互作用力的总称
B.分子间氢键的形成除使物质的熔、沸点升高,对物质的溶解、电离等也都有影响
C.范德华力与氢键可同时存在于分子之间
D.氢键是一种特殊的化学键,它广泛存在于自然界中
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质按熔点由高到低排列的顺序正确的是( )
A.NaCl、SiO2、CO2、Na B.Na、NaCl、CO2、SiO2
C.CO2、Na、NaCl、SiO2 D.SiO2、NaCl、Na、CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
诺贝尔化学奖得主泽维尔研究发现,当激光脉冲照射NaI时,Na+和I-两核间距在10~15 ,呈离子键;当两核靠近约2.8
,呈离子键;当两核靠近约2.8 时,呈共价键。根据泽维尔的研究成果能得出的结论是( )
时,呈共价键。根据泽维尔的研究成果能得出的结论是( )
A.NaI晶体是离子晶体和分子晶体的混合物 B.共价键和离子键没有明显的界限
C.NaI晶体中既有离子键,又有共价键 D.离子晶体可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
关于SO2的叙述中正确的是( )
A.SO2通入氯水后,溶液褪色,酸性减弱
B.是酸性氧化物,溶于水得稳定的亚硫酸
C.SO2气体通入NaOH溶液一定得到Na2SO3
D.S、SO2、SiO2三种物质均能与NaOH溶液反应,各自又能与某些酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列物质中,可形成酸雨的是______。
A.二氧化硫 B.氟氯代烃
C.二氧化碳 D.甲烷
(2)现有以下几种措施:①对燃烧煤时产生的尾气进行除硫处理;②少用原煤作燃料;③燃煤时鼓入足量空气;④开发清洁能源。其中能减少酸雨产生的措施是______。
A.①②③ B.②③④
C.①②④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。
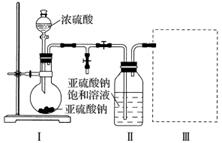
(1)装置Ⅰ中产生气体的化学方程式为__________________________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是________________________________________________________________________
________________________________________________________________________。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为__________(填序号)。
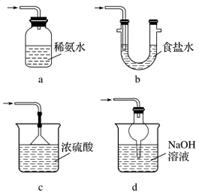
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO 的电离程度大于水解程度,可采用的实验方法是_____(填序号)。
的电离程度大于水解程度,可采用的实验方法是_____(填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
X和Y均为短周期元素,X原子的最外层电子数是次外层电子数的2.5倍,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的分子式可表示为 ( )
A.XY B.XY2
C.XY3 D.XY4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com