
| t/s | 0 | 500 | 1000 |
| c(N2O5) mol/L | 5.00 | 3.25 | 2.48 |
| c2(N2O5) |
| c4(NO2)c(O2) |
| c2(N2O5) |
| c4(NO2)c(O2) |
| 2.53mol/L |
| 1000s |


科目:高中化学 来源: 题型:
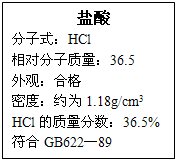 右图为某市售盐酸试剂瓶标签上的部分数据,通过计算回答:
右图为某市售盐酸试剂瓶标签上的部分数据,通过计算回答:查看答案和解析>>
科目:高中化学 来源: 题型:
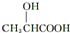 )有关的化学方程式:
)有关的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
物质 n/mol T/℃ |
活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内气体密度不再发生变化 |
| B、容器内各物质的浓度不再发生变化 |
| C、正反应和逆反应都已停止 |
| D、单位时间消耗0.1mol N2的同时生成0.2mol NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com