
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s)2Ca2++2K++Mg2++4SO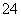 +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
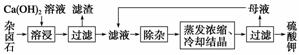
(1)滤渣主要成分有________和________以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:____________
____________________________________________________________。
(3)“除杂”环节中,先加入________溶液,经搅拌等操作后,过滤,再加入__________溶液调滤液pH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系见下图。由图可得,随着温度升高,①____________ ____,②__________________。
____,②__________________。

(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+ CO
CO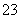 CaCO3(s)+SO
CaCO3(s)+SO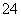
已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K(计算结果保留三位有效数字)。
解析 解题时,要依据制备K2SO4的工艺流程,结合物质的分离与提纯的原则进行分析。
(1)杂卤石中加入Ca(OH)2溶液,Mg2+与OH-结合生成Mg(OH)2沉淀,CaSO4微溶于水,过滤后,滤渣中含有Mg(OH)2、CaSO4及未溶解的杂卤石。
(2)加入Ca(OH)2溶液,Mg2+与OH-结合生成Mg(OH)2沉淀,使c(Mg2+)减小,杂卤石的溶解平衡正向移动,同时c(Ca2+)与c(SO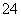 )均增大,从而析出CaSO4沉淀,K+留在滤液中。
)均增大,从而析出CaSO4沉淀,K+留在滤液中。
(3)滤液中含有Ca2+、OH-,可先加入过量K2CO3溶液,除去Ca2+,过滤后,再加入稀H2SO4调节溶液的pH至中性。
(4)由图可知,随着温度升高,溶浸平衡向右移动,K+的溶浸速率增大。
(5)CaSO4(s)+CO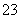 CaCO3(s)+SO
CaCO3(s)+SO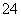 的平衡常数K=
的平衡常数K=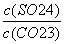 。CaCO3(s)、CaSO4(s)分别存在溶解平衡:CaCO3(s)Ca2+(aq)+CO
。CaCO3(s)、CaSO4(s)分别存在溶解平衡:CaCO3(s)Ca2+(aq)+CO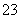 (aq),CaSO4(s)Ca2+(aq)+SO
(aq),CaSO4(s)Ca2+(aq)+SO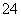 (aq),则有Ksp(CaCO3)=c(Ca2+)·c(CO
(aq),则有Ksp(CaCO3)=c(Ca2+)·c(CO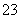 )=2.80×10-9,Ksp(CaSO4)=c(
)=2.80×10-9,Ksp(CaSO4)=c( Ca2+)·c(SO
Ca2+)·c(SO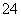 )=4.90×
)=4.90×
10-5,那么K=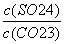 =
=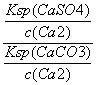 =
=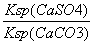 =
=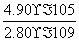 =1.75×104。
=1.75×104。
答案 (1)Mg(OH)2 CaSO4
(2)加入Ca(OH)2溶液,Mg2+与OH-结合生成Mg(OH)2沉淀,Mg2+浓度减小 ,平衡正向移动,K+增多
,平衡正向移动,K+增多
(3)K2CO3 H2SO4
(4)①溶浸平衡向右移动 ②K+的溶浸速率增大
(5)CaSO4(s)+CO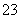 CaCO3(s)+SO
CaCO3(s)+SO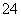 的平衡常数K=
的平衡常数K=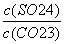 ,据Ksp(CaSO4)、Ksp(CaCO3)可知,c(SO
,据Ksp(CaSO4)、Ksp(CaCO3)可知,c(SO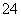 )=
)=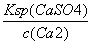 ,c(CO
,c(CO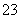 )=
)=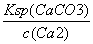 ,则有K=
,则有K=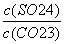 =
=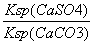 =
=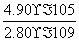 =1.75×104。
=1.75×104。
方法技巧 要求用理论回答的试题,应采用“四段论法”:改变了什么条件(或是什么条件)→根据什么理论→有什么变化→得出什么结论。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
下列叙述中不正确的是( )
A.目前,我国城市环境污染中的大气污染物主要是SO2、NO2、CO、烟尘
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
D.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
查看答案和解析>>
科目:高中化学 来源: 题型:
1.92gCu片与一定量的浓HNO3作用,当收集到NO2和NO气体共1.12L时(标准状况),
金属铜恰好全部作用。则:
(1)反应中消耗HNO3 mol,转移电子 mol
(2)用排水法收集生成的气体,最后气体的体积为 L (标准状况)
(3)向收集到的气体中通入 mL O2(标准状况)才能使水刚好充满整个集气容器。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关有机化学实验的说法中,错误的是
A.除去乙醇中少量乙酸:加入足量生石灰蒸馏
B.乙烯和乙醇都能使酸性KMnO4溶液褪色
C.实验室里制备少量乙酸乙酯可用饱和Na2CO3溶液接收生成物
D.分离甘油和氯化钠溶液用分液的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
0.2 mol有机物和0.4 mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物经过浓硫酸后,浓硫酸的质量增加10.8 g;再通过灼热CuO充分反应后,固体质量减轻3.2 g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6 g。0.1 mol该有机物恰好与4.6 g金属钠完全反应。下列关于该有机物的说法不正确的是
A.该化合物的相对分子质量是62 B.该化合物的化学式为C2H6O2
C.1 mol该化合物能与2 mol O2发生催化氧化反应
D.1 mol该有机物最多能与2 mol Na反应
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),主要工艺流程如下。

(1)将过程②产生的气体通入下列溶液中,溶液会褪色的是________(填字母序号)。
A.品红溶液 B.紫色石蕊试液
C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS、O2和H2SO4反应的化学方程式为____________________________
________________________________ ________________________________________。
________________________________________。
(3)过程③中需加入的物质是________________。
(4)过程④中,蒸发结晶时需使用的仪器除酒精灯、三脚架外,还需要________________。
(5)过程⑤调节pH可选用下列试剂中的________(填序号)
A.稀硫酸 B.CaCO3 C.NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质的用途,不正确的是
A.小苏打可用于治疗胃酸过多 B.Cl2可与石灰乳反应制取漂白粉
C.镁铝合金可用作制造飞机的材料 D.高纯硅用来制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
某待测液中可能含有A13+、Fe3+、K+、NH4+、C1-等离子,现通过如下实验对其中的阳离子进行检验:【来源:21·世纪·教育·网】
(1)取少量待测液,仔细观察,呈无色;
(2)向上述待测液中滴加NaOH溶液,有白色沉淀生成,NaOH溶液过量后沉淀又完全溶解,再加热还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝。
据此可以判断该待测液中一定含有的阳离子是 ,一定没有的阳离子是 。还有一种阳离子没有检验,检验这种离子的实验方法是(填写实验名称) ,现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对化学用语的理解正确的是
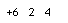 A.原子结构示意图
A.原子结构示意图
 表示12C,也可以表示14C
表示12C,也可以表示14C
B.球棍模型 
 表示二氧化碳分子,也可以表示二氧化氮分子
表示二氧化碳分子,也可以表示二氧化氮分子
C.电子式 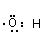
 表示羟基,也可以表示水失去氢离子剩下的部分
表示羟基,也可以表示水失去氢离子剩下的部分
D.电子排布式为1s22s22p4 表示氧元素简单阴离子,也可表示F-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com