
 ;
;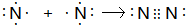 ;
;分析 A、B、D、E、F、G为短周期元素,且原子序数依次递增.A、F同主族,F可以形成+1价F+离子,二者处于ⅠA族,由A、F的原子序数之差可知,F为Na元素;
A与其它非金属元素化合时易形成共价键,则A为氢元素;
F+离子与E2-离子核外电子排布相同,离子核外电子数为10,故E为氧元素;
E、G同主族,则G为S元素;
D形成双原子分子,D原子序数小于氧元素,处于第二周期,则D为N元素;
物质BE和D2具有相同的电子数,则B原子核外电子数为2×7-8=6,则B为碳元素,据此解答.
解答 解:A、B、D、E、F、G为短周期元素,且原子序数依次递增.A、F同主族,F可以形成+1价F+离子,二者处于ⅠA族,由A、F的原子序数之差可知,F为Na元素;
A与其它非金属元素化合时易形成共价键,则A为氢元素;
F+离子与E2-离子核外电子排布相同,离子核外电子数为10,故E为氧元素;
E、G同主族,则G为S元素;
D形成双原子分子,D原子序数小于氧元素,处于第二周期,则D为N元素;
物质BE和D2具有相同的电子数,则B原子核外电子数为2×7-8=6,则B为碳元素,
(1)F为Na元素,位于第三周期第ⅠA族,
故答案为:三;ⅠA;
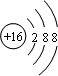
(2)G为硫元素,S2-离子结构示意图为 ,
,
故答案为: ;
;
(3)用电子式表示N2的形成过程为: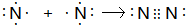 ;故答案为:
;故答案为: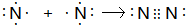 ;
;
(4)由A、E、F三种元素形成的化合物的化学式为NaOH,含有的化学键有离子键和极性共价键,属于离子化合物,故答案为:NaOH;离子键和极性共价键;离子;
(5)B为碳元素,其最高价是+4,由H、C组成的化合物中,含氢量最高的气态物质的化学式是CH4,与N2式量相等的物质的化学式是C2H4,含有的化学键有极性键、非极性键,含有6对共用电子对,故答案为:+4;CH4;C2H4;极性键、非极性键;6.
点评 本题考查结构性质位置关系,涉及常用化学用语、化学键、元素化合物知识等,元素的推断是解答的关键,难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 李白的诗句:“日照香炉生紫烟,遥看瀑布挂前川.”生紫烟包含了物理变化 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,北宋沈括用胆矾炼铜的过程属于置换反应 | |
| C. | 唐末五代时期丹学著作《元妙道要略》中有云“以硫黄、雄黄台硝石并蜜烧之;焰起,烧手面及烬屋舍者”.描述的是丹药的制作过程 | |
| D. | 古剑沈卢“以济钢为刃,柔铁为茎干,不尔则多折断”. 济钢指的是铁的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
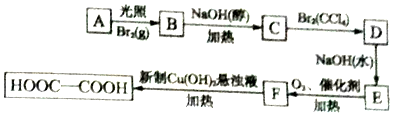
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 | |
| B. | 常温下,将pH=10的氨水稀释后,溶液中所有离子浓度都减小 | |
| C. | 常温下,0.1 mol/L Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在:c (Na+)=c(A-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 有关问题 |
| (1)计算所需NaOH的质量 | 需要NaOH的质量为4.0g |
| (2)称量NaOH固体 | 称量过程中主要用到的仪器是 托盘天平、药匙 |
| (3)将NaOH加入100mL烧杯中,加适量蒸馏水溶解 | 为加快溶解,可采取的措施是 搅拌、加热、研细氢氧化钠等措施 |
| (4)将烧杯中的溶液转移至500mL容量瓶中 | 为防止溶液溅出,应该采取的措施是 玻璃棒引流 |
| (5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是 加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶内有少量蒸馏水 | |
| B. | 溶液从烧杯中转移到容量瓶时,没有洗涤烧杯 | |
| C. | 定容时观察液面时俯视定容 | |
| D. | 配溶液的Na2CO3•10H2O晶体在空气中久置风化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com