
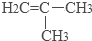 ;.
;.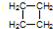 .
. 分析 有机物A蒸气的质量是同温同压下同体积N2的2倍,则该有机物的相对分子质量为2×28=56,则n(A)=$\frac{2.8g}{56g/mol}$=0.05mol,由原子守恒可知,n(C)=n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,n(H)=2n(H2O)=2×$\frac{3.6g}{18g/mol}$=0.4mol,故有机物分子中含有C原子数目为$\frac{0.2mol}{0.05mol}$=4,含有H原子数目为$\frac{0.4mol}{0.05mol}$=8,O原子数目为$\frac{56-12×4-8}{16}$=0,所以A的分子式为C4H8.
解答 解:(1)有机物A蒸气的质量是同温同压下同体积N2的2倍,则该有机物的相对分子质量为2×28=56,摩尔质量为56g/mol,
n(A)=$\frac{2.8g}{56g/mol}$=0.05mol,由原子守恒可知,n(C)=n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,n(H)=2n(H2O)=2×$\frac{3.6g}{18g/mol}$=0.4mol,故有机物分子中含有C原子数目为$\frac{0.2mol}{0.05mol}$=4,含有H原子数目为$\frac{0.4mol}{0.05mol}$=8,O原子数目为$\frac{56-12×4-8}{16}$=0,所以A的分子式为C4H8;
故答案为:56g/mol;C4H8;
(2)该有机物链状同分异构体的结构简式为:CH2=CHCH2CH3、CH3CH=CH2CH3、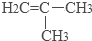 ,
,
故答案为:CH2=CHCH2CH3、CH3CH=CH2CH3、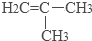 ;
;
(3)若有机物A在核磁共振氢谱中只有一个信号峰(即只有一种氢原子),则不可能为烯烃,应为环丁烷,结构简式为: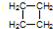 ,
,
故答案为: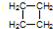 .
.
点评 本题考查了有机物分子式与结构式的确定、同分异构体书写等,掌握燃烧法利用原子守恒确定有机物分子式,试题培养了学生的分析计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
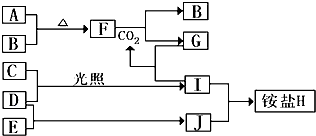
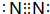 和
和 .
.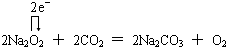 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀盐酸反应:Fe+2H+=Fe2++H2↑ | |
| B. | 氨水与盐酸反应:OH-+H+=H2O | |
| C. | 锌与硫酸铜溶液反应:Zn+Cu2+=Zn2++Cu | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
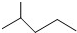 表示的分子式是C6H14;名称是2-甲基戊烷.
表示的分子式是C6H14;名称是2-甲基戊烷.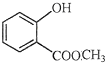 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.067mol | B. | 0.02mol | C. | 0.03mol | D. | 0.04mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2017届湖北省荆门市高三上九月联考化学试卷(解析版) 题型:填空题
镍(28Ni)金属羰基化合物[金属元素和一氧化碳(CO)中性分子形成的一类配合物]、金属储氢材料[能可逆的多次吸收、储存和释放氢气(H2)的合金]等领域用途广泛。
(1)Ni原子基态核外电子排布式为_________________。
(2)Ni(CO)4中镍的化合价为_____________,写出与CO互为等电子体的中性分子、带一个单位正电荷的阳离子、带一个单位负电荷的阴离子各一个:__________、_____________、___________。
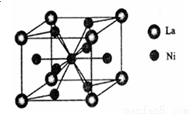
(3)一种储氢合金由镍与镧(La)组成,其晶胞结构如图所示.则该晶体的化学式为_________。
(4)下列反应常用来检验Ni2+,请写出另一产物的化学式__________。
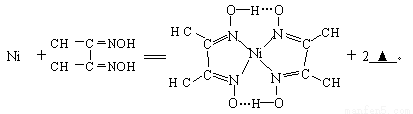
与Ni2+配位的N原子有_________个,该配合物中存在的化学键有__________(填序号)。
A共价键 B离子键 C配位键 D金属键 E氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com