
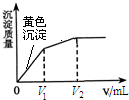
 向10mL含等浓度的I-和Cl-的溶液中逐滴加入0.1mol?L-1的AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法不正确的是( )
向10mL含等浓度的I-和Cl-的溶液中逐滴加入0.1mol?L-1的AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法不正确的是( )| A、该实验可以证明AgI比AgCl更难溶 |
| B、加入V2 mL AgNO3溶液后,溶液中不含I- |
| C、V1=V2-V1 |
| D、向最终的沉淀中加入Na2S溶液,沉淀变成黑色 |


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
 将物质的量浓度相等的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液的pH随时间t变化的曲线如图所示,则下列说法中不正确的是( )
将物质的量浓度相等的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液的pH随时间t变化的曲线如图所示,则下列说法中不正确的是( )| A、A点pH小于7是因为Cu2+水解使溶液显酸性 |
| B、BC段阳极产物是Cl2 |
| C、整个过程中阳极先产生Cl2,后产生O2 |
| D、CD段电解的物质是水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图装置模拟上述过程:
(1)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图装置模拟上述过程:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O→2HCO3- |
| B、FeSO4溶液在空气中变质:4Fe2++O2+2H2O→4Fe3++4OH- |
| C、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O→2Al(OH)3↓+CO32- |
| D、碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+2Ca2++4OH-→2CaCO3↓+Mg(OH)2↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②⑥ | B、⑥⑦ |
| C、①③⑤ | D、④⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、其溶液的pH=13 |
| B、加入少量NaOH,溶液中c(NH4+)减小,Kw减小 |
| C、与AlCl3溶液反应的离子方程式为Al3++3OH-=Al(OH)3↓ |
| D、滴加0.10mol?L-1 HNO3溶液到pH=7,溶液中离子浓度关系为:c(NO3-)=c(NH4+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是用0.1000mol?mol-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
如图是用0.1000mol?mol-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:| 实验 编号 |
待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) |
滴定后盐酸的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com