
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略去)如下:

有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g/cm3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,在55~65℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)仪器D的名称为_____。
(2)①滴加酸性Na2Cr2O7溶液时反应的离子方程式为______________;
②蒸馏不能分离环己酮和水的原因是_____。
(3)环己酮需要经过以下操作提纯:
a.往液体中加入NaCl固体至饱和,静置,分液
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.加入无水MgSO4固体,除去有机物中少量的水
d.过滤
e.蒸馏、除去乙醚后,收集151~156℃馏分
①b中水层用乙醚萃取的目的是_____;
②上述操作a、d中使用的玻璃仪器除烧杯、玻璃棒外,还需要的玻璃仪器有____、___,操作a中,加入NaCl固体的作用是_____。
(4)恢复至室温时,分离得到纯产品体积为8mL,则环己酮的产率为____。(保留3位有效数字)
【答案】(直形)冷凝管 3![]() +Cr2O72-+8H+=3
+Cr2O72-+8H+=3![]() +2Cr3++7H2O 环己酮和水形成具有固定组成的混合物将一起蒸出 使水层中少量的有机物进一步被提取,提高产品的产量 漏斗 分液漏斗 降低环己酮的溶解度,增加水层的密度,有利于分层 80.8%
+2Cr3++7H2O 环己酮和水形成具有固定组成的混合物将一起蒸出 使水层中少量的有机物进一步被提取,提高产品的产量 漏斗 分液漏斗 降低环己酮的溶解度,增加水层的密度,有利于分层 80.8%
【解析】
(1)装置D的名称是冷凝管;
(2)①Na2Cr2O7具有氧化性,可以将环己醇氧化为环己酮根据电子守恒、电荷守恒、原子守恒可得离子方程式;
②环己酮能与水形成具有固定组成的混合物,两者能一起被蒸出;
(3)①环己酮在乙醚中的溶解度大于在水中的溶解度,且乙醚和水不互溶,水层用乙醚萃取的目的是使水层中少量的有机物进一步被提取,提高产品的产量;
②分液需要的主要仪器为分液漏斗,过滤需要漏斗; NaCl能增加水层的密度,降低环己酮的溶解,有利于分层;
(4)环己醇的质量=10mL×0.96g/mL=9.6g,理论上得到环己酮质量=![]() 9.408g,实际上环己酮质量=8mL×0.95g/mL=7.6g,环己酮产率=
9.408g,实际上环己酮质量=8mL×0.95g/mL=7.6g,环己酮产率=![]() ×100%。
×100%。
(1)根据图示可知装置D的名称是冷凝管,具有冷凝蒸汽作用;
(2)①Na2Cr2O7具有氧化性,可以将环己醇氧化为环己酮根据电子守恒、电荷守恒、原子守恒可得离子方程式:3![]() +Cr2O72-+8H+=3
+Cr2O72-+8H+=3![]() +2Cr3++7H2O;
+2Cr3++7H2O;
②环己酮和水能形成具有固定组成的混合物,具有固定的沸点,蒸馏时能被一起蒸出,所以蒸馏难以分离环己酮和水的混合物。
(3)①环己酮在乙醚中的溶解度大于在水中的溶解度,且乙醚和水不互溶,水层用乙醚萃取的目的是乙醚能作萃取剂,能将水中的少量的有机物进一步被提取,从而提高产品产量;
②分液需要的主要仪器为分液漏斗,过滤需要由漏斗组成的过滤器;NaCl能增加水层的密度,降低环己酮的溶解,更有利于分层;
(4)环己醇的质量=10mL×0.96g/mL=9.6g,理论上得到环己酮质量==![]() 9.408g,实际上环己酮质量=8mL×0.95g/mL=7.6g,环己酮产率=
9.408g,实际上环己酮质量=8mL×0.95g/mL=7.6g,环己酮产率=![]() ×100%=
×100%=![]() 。
。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】2020年4月,我国自主设计,被称为“人造太阳”的“东方超环”核聚交实验装置取得重大突破,该核聚变的基础原料是海水中提取的氘和氚。下列叙述中错误的是
A.氘原子的相对原子质量为2
B.氚原子内中子数和核外电子数之差为1
C.氘原子和氚原子互为同位素
D.海水中的H2O与D2O互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是第二周期部分元素基态原子的电子排布图,据此下列说法错误的是( )


A. 每个原子轨道里最多只能容纳2个电子
B. 电子排在同一能级时,总是优先单独占据一个轨道
C. 每个能层所具有的能级数等于能层的序数(n)
D. 若原子轨道里有2个电子,则其自旋状态相反
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O3能吸收有害紫外线,保护人类赖以生存的空间。O3的分子结构如图,呈V形,两个键的夹角为116.5°,三个原子以一个O原子为中心,与另外两个O原子分别构成一个共价键;中间O原子提供两个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键——三个O原子均等地享有这些电子。请回答:

(1)臭氧与氧气互为________________。
(2)下列分子与O3分子的结构最相似的是________。
A. H2O B. CO2 C. SO2 D. BeCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学观或化学研究方法的叙述中,错误的是( )
A. 在化工生产中应遵循“绿色化学”的思想
B. 在过渡元素中寻找优良的催化剂
C. 在元素周期表的金属和非金属分界线附近寻找半导体材料
D. 根据元素周期律,由HClO4可以类推出氟元素的最高价氧化物的水化物为HFO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型药物H( )是一种可用于治疗肿瘤的药物,其合成路线如图所示:
)是一种可用于治疗肿瘤的药物,其合成路线如图所示:

已知:(1)E的分子式为C9H8O2,能使溴的四氯化碳溶液褪色
(2)![]() (R为烃基)
(R为烃基)
(3)![]()
请回答下列问题:
(1)A的结构简式为_____;D的官能团的名称为_____。
(2)①的反应类型是_____;④的反应条件是_____。
(3)写出B→C的化学方程式_____。
(4)写出F+G→H的化学方程式_____。
(5)E有多种同分异构体,同时满足下列条件的E的同分异构体有_____种。
ⅰ.能发生银镜反应 ⅱ.能发生水解反应 ⅲ.分子中含的环只有苯环
(6)参照H的上述合成路线,设计一条由乙醛和NH2CH(CH3)2为起始原料制备医药中间CH3CONHCH(CH3)2的合成路线_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业锅炉内壁的水垢,不仅浪费燃料,而且容易引发安全隐患。某碳素钢锅炉水垢(主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3、SiO2等)碱煮法清除的流程如下:

已知:20℃时几种难溶物的溶度积常数如下表(单位省略):

回答下列问题:
(1)“碱煮”环节,加入Na3PO4的主要目的是将CaSO4转化为Ca3(PO4)2,请写出该离子方程式______________________。
(2)“浸泡过程中,稀盐酸会溶解Fe2O3。溶解后的Fe2O3会加速锅炉腐蚀,故需“还原”处理。
①锅炉被加速腐蚀的原因是______________________;
②浸泡液还原”处理时,Sn2+转化为Sn4+,则反应中氧化剂与还原剂的物质的量之比为______________________。
(3)“钝化”处理的目的是在锅炉表面形成Fe3O4保护膜,同时生成可直接参与大气循环的气体。
①反应的离子方程式为_________________________________;
②为检验锅炉“钝化”处理后是否形成致密的保护膜,可往锅炉内壁刷上硫酸铜溶液。若观察到______________________(填现象),则保护膜致密性欠佳。
(4)柠檬酸(用H3R表示)可用作清除锅炉水垢的酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图所示。由此可推知,0.1 mol ·L-1 Na2HR溶液中各种阴离子浓度由大到小的排列顺序为______________________。
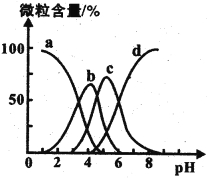
(5)用如图装置对锅炉用水(含Ca2+、Mg2+、HCO3-)进行预处理,可有效防止水垢形成。电解时,Ca2+形成沉淀的电极反应式为______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用加热氯酸钾的方法制取少量氧气。
(1)请写出反应的化学方程式。_____
(2)现欲制取1.12L(标准状况)氧气,理论上需要消耗氯酸钾多少克?生成氯化钾物质的量多少?______、______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个V升的密闭容器中放入2mol A(g)和1mol B(g),在一定条件下进行如下反应:3A(g)+B(g) ![]() nC(g) +2D(g),达平衡后A的浓度减小1/2,混合气体平均相对分子质量增大1/8,则该反应方程式中n的值是
nC(g) +2D(g),达平衡后A的浓度减小1/2,混合气体平均相对分子质量增大1/8,则该反应方程式中n的值是
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com