
下表是在相同温度下三种酸的一些数据,下列判断正确的是( )
| 酸 | HX | HY | HZ | ||
| 浓度(mol/L) | 0.12 | 0.2 | 0.9 | 1 | 1 |
| 电离度 | 0.25 | 0.2 | 0.1 | 0.3 | 0.5 |
| 电离常数 | K1 | K2 | K3 | K4 | K5 |
A.在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01
B.室温时,若在NaZ溶液中加水,则c(Z-)/ [c(HZ)• c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.在相同温度下,K5>K4>K3
【知识点】弱电解质在溶液中的电离平衡、盐类水解的应用
【答案解析】D 解析:A、相同温度下,同种弱酸的电离常数不随浓度的变化而变化,所以K1=K2=K3,故A错误;
B、室温时,若在NaZ溶液中加水、加酸都促进水解,c(Z-)/ [c(HZ)• c(OH-)] =Ka×Kw,二者都为常数,只受温度的影响,则比值不变,故B错误;
C、由电离度大小可知酸性HZ>HY>HX,酸越强,水解程度越小,则其c(Z-)>c(Y-)>c(X-),故C错误;
D、弱酸的电离度越大,酸越强,则电离常数越大,所以在相同温度下,K5>K4>K3,故D正确;
故答案选D
【思路点拨】本题考查本题考查了弱电解质的电离,根据电离程度确定电解质强弱,再结合酸的强弱与酸根离子水解程度大小的关系来分析解答,易错选项是B,将该式子进行改变得到Ka×Kw即可判断,注意:所有的平衡常数只与温度有关,不受其它因素影响,为易错点。


科目:高中化学 来源: 题型:
对下列实验现象描述不正确的是( )
A.木炭在氧气中燃烧,发出白光 B.硫在氧气中燃烧发出明亮的蓝紫色火焰
C.一氧化碳在空气中燃烧发出蓝色火焰 D.白磷在空气中燃烧发出淡蓝色火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来,因建设“PX”项目而引发的争议时有发生,PX是一种重要的化工原料,从化纤织物到食品包装,从医疗设备到家用电器,都要用到它的合成产物.PX的化学名称为对二甲苯,它是一种低毒化合物,毒性略高于酒精.
请回答下列有关问题:
(1)对二甲苯的分子结构模型如图所示,其中“ ”代表碳原子.“
”代表碳原子.“ ”代表氢原子.试根据分子模型写出对二甲苯的化学式 。
”代表氢原子.试根据分子模型写出对二甲苯的化学式 。
(2)对二甲苯中各元素的质量比 .
(3)PX项目之所以会引发各种争议,源于人们对它认识的局限性.结合题干信息,在下列各种观点中,选出你认同的一种观点 (选填字母).
A.PX是一种重要的化工原料,应该大力发展PX项目
B.在环保评估可行且监管到位的情况下,可以发展PX项目
C.化工项目一定会产生污染,应该禁止PX项目.

查看答案和解析>>
科目:高中化学 来源: 题型:
碘元素对青少年智力发育影响很大,加碘盐通常在食盐中加碘酸钾(KIO3).如图是超市销售的一种加碘盐标签上的部分文字说明.
请回答下列问题:
(1)食用“碘盐”属于 ;(纯净物或混合物)
(2)每袋该食盐中碘元素的质量 mg.
(3)中国营养学会推荐:一个18岁的青年每天摄入碘元素的质量为0.15mg.
假设碘的来源仅靠这种加碘食盐,该青年每天摄入这种食盐应为 g.

查看答案和解析>>
科目:高中化学 来源: 题型:
研究化肥的合成、废水的处理等有现实的重要意义。
Ⅰ.尿素是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
试回答下列问题:
(1)下列措施中有利于提高尿素的产率的是___________。
A.采用高温 B.采用高压 C.寻找更高效的催化剂
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1
H2NCOONH4(氨基甲酸铵) (l) △H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
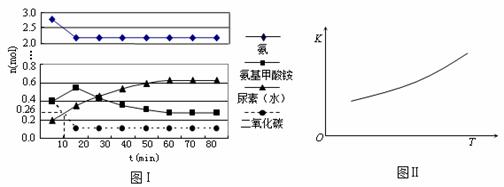
① 已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_____步反应决定。
② 反应进行到10 min时测得CO2的物质的量如图Ⅰ所示,则用CO2表示的第一步反应的速率v(CO2)=____________________
③ 第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2 0
(填“>”“<”或“=”)
Ⅱ.以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42 g/L | 1.6 g·L-1 |
| 排放标准 | pH 6~9 | 0.5 mg·L-1 |
表1.几种砷酸盐的Ksp 表2.工厂污染物排放浓度及允许排放标准
回答以下问题:
(3)若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,
c(AsO43-)最大是 mol·L-1。
(4)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式 。
(5)在处理含砷废水时采用分段式,先向废水中投入适量生石灰调节pH到2,再投入适量生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
① 将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ;
②在pH调节到8左右才开始出现大量Ca3(AsO4)2沉淀的原因为
查看答案和解析>>
科目:高中化学 来源: 题型:
下列比较中,正确的是( )
A.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大
B.物质的量浓度相等的NH4Cl和 NaOH溶液等体积混合后:
c(NH )>c(Cl)>c(Na)>c(OH)>c(H)
)>c(Cl)>c(Na)>c(OH)>c(H)
C.物质的量浓度相等的H2S和NaHS混合溶液中:
c(Na)+ c(H)=c(S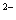 )+ c(HS)+ c(OH)
)+ c(HS)+ c(OH)
D.同物质的量浓度的下列溶液中,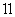 NH4Al(SO4)2、
NH4Al(SO4)2、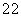 NH4Cl、
NH4Cl、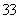 CH3COONH4、
CH3COONH4、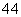 NH3·H2O;c(NH
NH3·H2O;c(NH )由大到小的顺序是:
)由大到小的顺序是: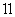 >
>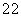 >
>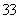 >
>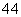
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是
A. 2NO2  N2O4 (正反应为放热反应)
N2O4 (正反应为放热反应)
B. C(s)+ CO2  2CO (正反应为吸热反应)
2CO (正反应为吸热反应)
C. N2 + 3H2  2NH3 (正反应为放热反应)
2NH3 (正反应为放热反应)
D. H2S  H2 + S(s)(正反应为吸热反应)
H2 + S(s)(正反应为吸热反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生。下列有关说法正确的是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com