
W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大。W原子核外有2个未成对电子,Q是电负性最大的元素,R元素的原子核外的未成对电子数是W原子核外未成对电子数的2倍。请回答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):
(l)W、Y、Z 三种元素的第一电离能由大到小的顺序为 。在上述三种元素的原子中,写出与WZ2互为等电子体的分子式 。
(2)已知Y2Q2分子存在如下所示的两种结构(球棍模型,短线不一定代表单键)

该分子中Y原子的杂化方式是 杂化。
(3)W2-2阴离子的电子式为 ,Z原子最外层电子排布式为 。
(4)YQ3分子的空间构型为 ,Y和Q两元素的氢化物的沸点相比较,高者是 (写分子式).往硫酸铜溶液中通入过量的YH3(Y的氢化物分子式),可生成配离子[Cu(YH3)4]2+,但YQ3不易与Cu2+形成配离子,其原因是 。
(5)科学家通过X射线探明RZ的晶体结构与NaCl晶体结构相似。那么在RZ晶体中距离R2+最近且等距离的R2+有 个。若在RZ晶体中阴阳离子间最近距离为a cm,晶体密度为ρg/cm3,则阿伏伽德罗常数NA的表达式为 mol-1。
(6)已知非整数比化合物R0.95Z,其晶体结构与NaCI相似,但由于R、Z离子个数比小于1:1,故晶体存在缺陷。R0.95Z可表示为( )

(1)N>O>C; N2O
(2)SP2
(3)  ;
2s22p4
;
2s22p4
(4)三角锥形;HF;由于电负性F>N>H,在NF3分子中,共用电子对偏向F原子,使得N原子上的孤电子对难与Cu2+配位
(5)12;36/ρa3
(6)B
【解析】
(1)根据题意“W原子核外有2个未成对电子”,1s22s22p2,W应为C,“Q是电负性最大的元素”Q应为F,“R元素的原子核外的未成对电子数是W原子核外未成对电子数的2倍”,R的电子排布式应为[Ar]4s23d6,R为Fe,W、Y、Z的电负性关系为N>O>C;CO2的电子数为22,与其是等电子体的是N2O。
据键角为120 。,故Y原子的杂化方式应为SP2。
联想到CaC2,可写出C2-的电子式;Z为氧,最外层电子排布式为2s22p4。
联想NH3的空间构型,则NF3应为三角锥形。NH3与HF的沸点相比较,因电负性F>N,HF的氢键强于NH3的氢键,故HF沸点较高。氨易于与Cu2+形成配离子,而NF3难与Cu2+形成配离子,由于电负性F>N>H,在NF3分子中,共用电子对偏向F原子,使得N原子上的孤电子对难与Cu2+配位
首先对NaCl的晶体结构要熟悉,在晶体中间从三维方向用三个 面去切割,可以得到三个平面,在每一面上,距离中心Na+最近的 Na+有4个,则晶体中共有12个。据上面推得可知,R为Fe,则FleO的摩尔质量为72。在NaCl晶体中,每个晶胞含有4个NaCl,故FeO中,
NA(2a)3ρ/4=56+16,NA=36/a3ρ
(6)设R2+有x个,则R3+就有0.95-x,根据化合物化合价代数和为零的原则,有等式(+2X)+[+3(0.95-X)]+(-2)=0,解得X=0.85,故R0.95Z可表示为R0.852+R0.103+Z,选项B正确。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z可形成Z2、Z3两种气态单质 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为56,中子数为30 |
查看答案和解析>>
科目:高中化学 来源: 题型:
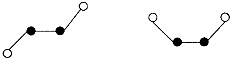
2+ 0.45 |
3+ 0.5 |
2+ 0.25 |
3+ 0.70 |
2+ 0.15 |
3+ 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com