
���� ��1����֪��CH4��g��+2O2��g��?CO2��g��+2H2O��g����H1=a kJ/mol
��CO��g��+H2O��g��?CO2��g��+H2��g����H2=b kJ/mol
��2CO��g��+O2��g��?2CO2��g����H3=c kJ/mol
��+2����-2���۵ã�CH4��g��+CO2��g��?CO��g��+2H2��g����H�����ݸ�˹���ɼ��㷴Ӧ�ȣ�
��2���ݷ�Ӧ����������֪���������ѭ������������Ϊ������̼����ԭ���غ���д��ѧ����ʽ��
��� �⣺��1����֪��CH4��g��+2O2��g��?CO2��g��+2H2O��g����H1=a kJ/mol
��CO��g��+H2O��g��?CO2��g��+H2��g����H2=b kJ/mol
��2CO��g��+O2��g��?2CO2��g����H3=c kJ/mol
�ݸ�˹���ɣ���+2����-2���۵ã�CH4��g��+CO2��g��?CO��g��+2H2��g����H=��a+2b-2c��kJ/mol��
�ʴ�Ϊ��CH4��g��+CO2��g��?CO��g��+2H2��g����H=��a+2b-2c��kJ/mol��
��2���ݷ�Ӧ����������֪���������ѭ������������Ϊ������̼����ԭ���غ���д��ѧ����ʽΪ��3CO+3H2�TCH3OCH3+CO2��
�ʴ�Ϊ��3CO+3H2�TCH3OCH3+CO2��
���� ���⿼�����Ȼ�ѧ����ʽ����д����ȷ��˹���ɼ��㷴Ӧ�ȵķ����ǽ���ؼ�����Ŀ�ѶȲ���


 ��������������������ϵ�д�
��������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ˮ���Ȼ�����Һ | B�� | ��ˮ�����Ը��������Һ | ||
| C�� | �Ȼ�����Һ��̼������Һ | D�� | �Ȼ�����Һ�����Ը��������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ӣ�������������Һ�������ֹ��Һ | |
| B�� | �Ҵ���ˮ��������������ʯ�ң����� | |
| C�� | �屽���壩����������������Һ�������ֹ��Һ | |
| D�� | ���ᣨ�Ҵ�������������ƣ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
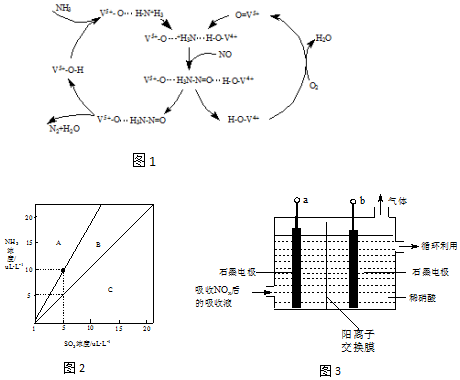
 ��1����һ��������N2��H2��Ӧ����NH3����ش�
��1����һ��������N2��H2��Ӧ����NH3����ش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
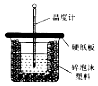
 �Ժ������ʵ��о����������ż�Ϊ��Ҫ�����壮
�Ժ������ʵ��о����������ż�Ϊ��Ҫ�����壮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ƭ��ϡ���ᷴӦ��ȡ����ʱ������ 98%��Ũ������Լӿ�������������� | |
| B�� | 100mL2mol•L-1 �������пƬ��Ӧ�������������Ȼ�����Һ����Ӧ���ʲ��� | |
| C�� | SO2 �Ĵ�������һ�����ȵķ�Ӧ�����������¶ȣ���Ӧ���ʼ��� | |
| D�� | ����β���е� NO �� CO ���Ի�����Ӧ���� N2 �� CO2����Сѹǿ��Ӧ���ʼ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����ʾ��������
����ʾ��������  �ɼ�д�ɡ���
�ɼ�д�ɡ���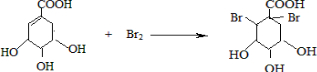 ��
��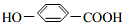 �����䷴Ӧ��������ȥ��Ӧ��
�����䷴Ӧ��������ȥ��Ӧ��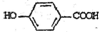 +2Br2��
+2Br2��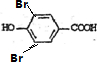 +2HBr��
+2HBr���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com