


科目:高中化学 来源: 题型:
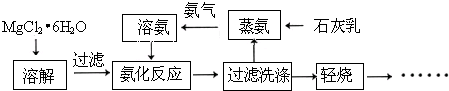
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用Ba(NO3 )2溶液鉴别Na2SO3和Na2SO4 | B、除去苯中少量苯酚,向混合物中加入足量的NaOH溶液后过滤 | C、将碘水和CCl4倒入分液漏斗,振荡后静置,可将碘萃取到CCl4中 | D、取0.1mol FeCl3溶于蒸馏水,用100mL容量瓶定容后得到1 mol?L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源:2010—2011学年广东省梅州市曾宪梓中学高二上学期期末考试理综)化学部分 题型:填空题
(16分)
(1)下列有关实验操作或结果的说法中错误的是
A.实验室在配制FeCl3溶液时,先将FeCl3溶于一定量的浓盐酸中,再加蒸馏水稀释至所需浓度
B.用广泛pH试纸测量Na2S溶液的pH时,得pH=10.5
C.滴定管洗净后经蒸馏水润洗后,即可注入标准液进行中和滴定实验
D.电解盐酸溶液后(盐酸过量),再通入一定量HCl气体时,电解质溶液可恢复到和原来一样
(2)氢氧化铝的酸式电离方程式:
(3)向明矾溶液中逐滴加入氢氧化钡溶液至铝离子刚好沉淀完全时,离子反应总方程式为:
(4)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) 。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(5)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失), 和 两种粒子的物质的量之和比OH―多0.05mol。
查看答案和解析>>
科目:高中化学 来源:2012届广东省梅州市高二上学期期末考试理综)化学部分 题型:填空题
(16分)
(1)下列有关实验操作或结果的说法中错误的是
A.实验室在配制FeCl3溶液时,先将FeCl3溶于一定量的浓盐酸中,再加蒸馏水稀释至所需浓度
B.用广泛pH试纸测量Na2S溶液的pH时,得pH=10.5
C.滴定管洗净后经蒸馏水润洗后,即可注入标准液进行中和滴定实验
D.电解盐酸溶液后(盐酸过量),再通入一定量HCl气体时,电解质溶液可恢复到和原来一样
(2)氢氧化铝的酸式电离方程式:
(3)向明矾溶液中逐滴加入氢氧化钡溶液至铝离子刚好沉淀完全时,离子反应总方程式为:
(4)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) 。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(5)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失), 和 两种粒子的物质的量之和比OH―多0.05mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com