
����Ŀ��25��ʱ����1L���ܱ������г���NO2�������·�Ӧ��2NO2(g)![]() N2O4(g)��H=��57 kJ��mol-1��N2O4��25��ʱΪ��ɫ���壩��
N2O4(g)��H=��57 kJ��mol-1��N2O4��25��ʱΪ��ɫ���壩��
��1���÷�Ӧ����S__________0������������������������������
��2������ʼ����0.03mol��NO2ʱ��25��ʱ��ʵ����NO2��ƽ��Ũ��Ϊ0.01 mol��L-1����NO2��ƽ��ת���ʣ�������_____________��25��ʱ������Ӧ��ƽ�ⳣ��K =_________��
��3��25��ʱ��ʵ���ø÷�Ӧ�Ļ��Ea=92.4 kJ��mol-1������������ϵͼ��������_____��
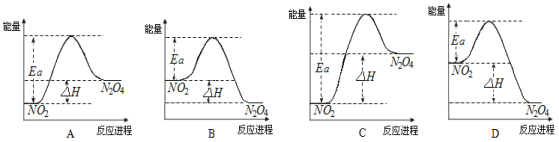
��4����Ѹ��ܱ���������80������ˮ�У����������ɫ___________����������������������������dz������NO2��ת����___________����������������������������С������
���𰸡��� 66.7% 100 B ���� ��С
��������
��1��2NO2��g��N2O4��g����H=-57kJmol-1�����ݷ�Ӧ������֪��Ӧ�����������С�������ر�С��0����S��0��
��2����1L���ܱ������г���NO2�������·�Ӧ��2NO2��g��N2O4��g����H=-57kJmol-1������ʼ����0.03mol��NO2ʱ��25��ʱ��ʵ����NO2��ƽ��Ũ��Ϊ0.01molL-1�����ݻ�ѧƽ������ʽ��ʽ���㣺����������ʼŨ��Ϊ0.03mol/L��
2NO2��g��N2O4��g��
��ʼ����mol/L�� 0.03 0
�仯����mol/L�� 0.02 0.01
ƽ������mol/L�� 0.01 0.01
NO2��ƽ��ת���ʣ�����=![]() ��100%=66.7%��
��100%=66.7%��
ƽ�ⳣ��K=![]() =
= ![]() =100L/mol��
=100L/mol��
��3�����ݷ�Ӧ�Ƿ��ȷ�Ӧ�������������������������������������ͼ����������ֵ���ڷ�Ӧ�ʱ��жϣ�B���ϣ�A��C�ж�������������������������������Dѡ������ֵС�ڷ�Ӧ�ʱ䣬���ʴ�ΪB��
��4��2NO2��g��N2O4��g����H=-57kJmol-1����Ӧ�Ƿ��ȷ�Ӧ�����������Ǻ���ɫ���壬��������������ɫ���壬����80�����ˮ�У�ƽ��������У�������ɫ���NO2��ת���ʼ�С��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ĵ���֦���̲طḻ�ķ����ѡ�����Դ������������(��Ҫ�ɷ�ΪTiO2��FeO��Fe2O3��Ti������ϼ�Ϊ��4)��ԭ�ϣ�������ɫ���϶������ѵ���Ҫ�������£�

��ش��������⣺
��1��������������ѷ�Ӧ�Ļ�ѧ����ʽ��_____��
��2������Һ���м������ۣ�������Ӧ�����ӷ���ʽΪ_____��_______��
��3�����˷����ˮ�϶������ѳ�������Һ���ص���ҪĿ���dz��������Һ�е����Ρ�H2O��_____��______(�ѧʽ)�����ٷ����ŷš�
��4��A������������ɫ����(Fe2O3)����ʵ�鷽���ǣ�
a.5.56akgA(Ħ������Ϊ278g��mol-1)����ˮ�У�������������������Һǡ����ȫ��Ӧ�����������������裬�������ɫ���壻
b.������ɫ�����м���33.36bkgA��1.12ckg ���ۣ����������������裬��Ӧ��ɺ��д���Fe2O3�����ڽ����������Գ�����ʽ������
c.���˺������������յú�ɫ���ϡ�
��������Һ������ֻ������غ����������������Ͽ�������ɫ����______kg��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ϊ2 L�����������ܱ������зֱ����1molSiHCl3��ά���������¶ȷֱ�ΪT1���T2�治�䣬������Ӧ��2SiHCl3(g)![]() SiH2Cl2(g)��SiCl4(g) ��H1��a kJ��mol1����Ӧ������SiHCl3��ת������ʱ��ı仯��ͼ��ʾ������˵����ȷ����
SiH2Cl2(g)��SiCl4(g) ��H1��a kJ��mol1����Ӧ������SiHCl3��ת������ʱ��ı仯��ͼ��ʾ������˵����ȷ����

A.T1��T2
B.T1��ʱ��0~100min��Ӧ��ƽ������v(SiHCl3)��0.001mol��(L��min)��1
C.T2��ʱ����Ӧ��ƽ�ⳣ����K��1/64
D.T2��ʱ��ʹ�ú��ʵĴ�������ʹSiHCl3��ƽ��ת������T1��ʱ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���ͼװ�õ�������ȷ����
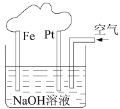
A.������Pt����Fe
B.���ǵ��NaOH��Һ��װ��
C.��װ����FeΪ�������缫��ӦΪ��Fe��2e����2OH��=Fe(OH)2
D.��װ����PtΪ�������缫��ӦΪ��O2 + 2H2O + 4e����4OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.1molij��̬�������ȼ�տ�������7.2��ˮ����ݴ˻ش��������⣺
��1��ͨ������ȷ�������ķ���ʽ����Ϊ_____��______���ɲ���������
��2�������ⶨ��������֧����������Ľṹ��ʽΪ________����ͬ���칹���ж��֣�д����ͬ����������ͬ���칹��Ľṹ��ʽ���������ɲ���������
�ṹ��ʽ��________���ƣ�________��
�ṹ��ʽ��________���ƣ�________��
�ṹ��ʽ��________���ƣ�________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(FexNy)�ڴż�¼�����������Ź㷺��Ӧ��ǰ����ijFexNy���Ʊ���������������ͪ���Ҵ����롣
��1��Fe2+�ļ۵����Ų�ʽΪ_______��
��2���������������£�N2H4���е�ԭ�ӹµ��Ӷ���֮��Ϊ_______�������ӵĿռ乹����______
��3����ͪ(![]() )������̼ԭ�ӹ�����ӻ�������_____��1 mol ��ͪ�����к�����������ĿΪ______��
)������̼ԭ�ӹ�����ӻ�������_____��1 mol ��ͪ�����к�����������ĿΪ______��
��4��C��N��O����Ԫ�صĵ縺����С�����˳��Ϊ______��
��5���Ҵ��ķе���ڱ�ͪ��������Ϊ_____��
��6��CN-��N2�ǵȵ����壬CN-�ĵ���ʽΪ______��
��7��ijFexNy�ľ�����ͼ1��ʾ��Cu������ȫ����þ�����aλ��Fe����bλ��Fe���γ�Cu����Ͳ���Fe(xn)CunNy��FexNyת��Ϊ����Cu����Ͳ���������仯��ͼ2��ʾ�����и��ȶ���Cu����Ͳ���Ļ�ѧʽΪ___������������Ϊa pm����þ������ܶ�Ϊ____g/cm3��
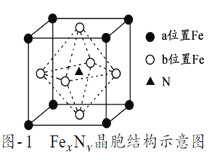
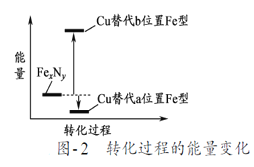
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�Ȼ�ѧ����ʽ��
�� C2H2(g) +![]() O2(g) = 2CO2(g)��H2O(l) ��H1��-1301.0 kJmol-1
O2(g) = 2CO2(g)��H2O(l) ��H1��-1301.0 kJmol-1
�� C(s)+ O2(g) = CO2(g) ��H2��-393.5 kJmol-1
�� H2(g)+![]() O2(g) = H2O(l) ��H3 = -285.8 kJ��mol-1
O2(g) = H2O(l) ��H3 = -285.8 kJ��mol-1
��Ӧ�� 2C(s)+ H2(g) = C2H2(g)����HΪ( )
A.+228.2 kJ��mol-1B.-228.2 kJ��mol-1
C.+1301.0 kJ��mol-1D.+621.7 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Դ���ճ�����߿Ƽ������ж��й㷺Ӧ�á�
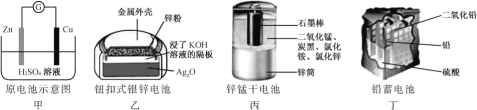
����˵������ȷ���ǣ� ��
A. �ף�Zn2+��Cu�缫�����ƶ���Cu�缫������Һ��H+Ũ������
B. �ң������ĵ缫��ӦʽΪAg2O��2e��H2O2Ag��2OH
C. ����пͲ������������������Ӧ��пͲ��䱡
D. ������طŵ�����У�����Ũ�Ȳ��ϼ��١�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ζ��Ƿ�����ѧ����Ҫ�ķ�������֮һ��������ԭ���ش��������⣺
I������к͵ζ���������ĵζ�������
(1)�ζ���������к͵ζ�����Ҫ����������25mL��ʽ�ζ����м�������������Һ����ʼʱ�ζ��ܵĶ���Ϊ10.00mL�����ζ����е�Һ��ȫ���ų����ų�����������Һ�����Ϊ____________����������������С����������������15.00mL��
(2)���ʽ�ζ�����ע���������������Һ֮ǰ��һ������Ϊ��_______________��
(3)ȷ��ȡ20.00 mLij����HCl��Һ����ƿ�У���0.1000 mol/LNaOH��Һ�ζ�������˵����ȷ������______��
A.��ƿ������ˮϴ�Ӻ��ô���HCl��Һ��ϴ
B.����NaOH��Һ���룬��ƿ����ҺpH��С���
C.�÷�̪��ָʾ��������ƿ����Һ�ɺ�ɫ����ɫʱֹͣ�ζ�
D.�ζ����յ�ʱ�����ֵζ��ܼ��첿�������Σ���ⶨ���ƫ��
II��������ԭ�ζ�Ҳ�Ƿ�����ѧ�г��õķ����ֶΣ���������ԭ�ζ������ⶨ��Ʒ��Na2S2O35H2O������������
ʵ�鲽�裺��ȡ6g��Ʒ����250mL����Һ���á�����ʽ�ζ���ȡ25.00mL0.01mol/L K2Cr2O7��Һ����ƿ�У�Ȼ����������KI��Һ���ữ���Ӽ��ε�����Һ�����������Ƶ�Na2S2O3��Һ�ζ����յ㣨��ӦΪI2+2S2O32-=2I��+S4O62����������Na2S2O3��Һ25.00mL���ش��������⣺
(1)��K2Cr2O7��Һ�м��������KI��Һ���ữ��Cr2O72-����ԭ��Cr3+��д���÷�Ӧ�����ӷ���ʽ_____��
(2)��Na2S2O3��Һ�ζ����յ������Ϊ_________________________��
(3)��Ʒ��Na2S2O35H2O����������Ϊ___________________��
(4)����ȡK2Cr2O7��Һʱ�в�����Һ�ε�����ƿ�⣬��ⶨ���ƫ_________������������������������������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com