
【题目】U、V、W、X、Y和Z为原子序数依次增大的六种短周期元素。U为非金属元素,且U与X同主族;V与X两元素的最高正化合价之和为6;W与Y同主族;X的周期数是族序数的3倍;Y的最外层电子数是最内层电子数的3倍。
请推测出U、V、W、X、Y和Z六种元素,并用相应的化学用语或者.化学符号回答下列问题:
(1)V的原子结构示意图为___,W、X、Y三种元素的原子半径由大到小的顺序为___。
(2)物质VU4Z的电子式为___,存在的化学键有___。
(3)U与W能形成的18e-分子的结构式为___,W的化合价为___。
(4)W和U两元素形成的阴离子与V和U两元素形成的阳离子含有相同的电子数,且在水溶液中、加热条件下能够发生反应生成含相同电子数的两种分子,该反应的离子方程式为___。
(5)加热搅拌条件下,XZW3能将强酸性溶液中的Fe2+氧化成Fe3+,当消耗1molXZW3时,转移6mole-,其离子方程式是___。
【答案】 r(Na)>r(S)>r(O)(或Na>S>O)
r(Na)>r(S)>r(O)(或Na>S>O) ![]() 离子键和共价键(或“离子键和极性键”或“离子键和极性共价键”) H-O–O-H -1价 NH4++OH-
离子键和共价键(或“离子键和极性键”或“离子键和极性共价键”) H-O–O-H -1价 NH4++OH-![]() NH3↑+H2O 6Fe2++6H++ClO3-
NH3↑+H2O 6Fe2++6H++ClO3-![]() 6Fe3++Cl-+3H2O
6Fe3++Cl-+3H2O
【解析】
U、V、W、X、Y和Z为原子序数依次增大的六种短周期元素,X的周期数是族序数的3倍,故X为Na元素;U为非金属元素,且U与X同主族,U为H元素;V与X两元素的最高正化合价之和为6,Na元素最高正化合价为1,所以V的最高正价为+5,即V在第VA族,又V的原子序数比Na小,所以V为N元素;Y为第三周期元素,又Y的最外层电子数是最内层电子数的3倍,所以Y为S元素;W与Y同主族,故W为O元素,Z的原子序数比S大且Z为短周期元素,所以Z为Cl元素,故U、V、W、X、Y和Z分别为H、N、O、Na、S、Cl六种元素,据此分析解答此题。
由分析可知,U、V、W、X、Y和Z分别为H、N、O、Na、S、Cl六种元素。
(1)V为N元素,核内有7个质子,核外有7个电子,最外层有5个电子,原子结构示意图为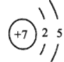 ;原子的电子层数越多,半径越大,电子层数相同的原子,核内质子数越多,半径越小,W、X、Y分别是O、Na、S,电子层数分别为2、3、3,质子数分别为8、11、16,故O、Na、S三种元素的原子半径由大到小的顺序为:r(Na)>r(S)>r(O)(或Na>S>O);
;原子的电子层数越多,半径越大,电子层数相同的原子,核内质子数越多,半径越小,W、X、Y分别是O、Na、S,电子层数分别为2、3、3,质子数分别为8、11、16,故O、Na、S三种元素的原子半径由大到小的顺序为:r(Na)>r(S)>r(O)(或Na>S>O);
(2)物质VU4Z的化学式为NH4Cl,属于离子化合物,由阴阳离子以离子键构成,电子式为:![]() ;NH4Cl中铵根离子与氯离子之间为离子键,铵根中氮原子和氢原子之间为极性共价键,答案为:
;NH4Cl中铵根离子与氯离子之间为离子键,铵根中氮原子和氢原子之间为极性共价键,答案为:![]() ;离子键和共价键(或“离子键和极性键”或“离子键和极性共价键”);
;离子键和共价键(或“离子键和极性键”或“离子键和极性共价键”);
(3)U与W即H与O元素,形成的常见化合物有H2O、H2O2,其中H2O2为18电子分子,结构式为H–O–O–H,其中H为+1价,O为-1价,答案为:H–O–O–H;-1价;
(4)W和U两元素形成的阴离子与V和U两元素形成的阳离子分别是OH-和NH4+,OH-和NH4+在加热的条件下生成NH3和H2O,OH-、NH4+、NH3、H2O都含有10个电子,都属于10电子微粒,反应的离子方程式为:NH4++OH-![]() NH3↑+H2O;
NH3↑+H2O;
(5)XZW3为HClO3,HClO3能将强酸性溶液中的Fe2+氧化成Fe3+,当消耗1mol HClO3时,转移6mole-,即一个氯原子得到6个电子,HClO3中Cl 为+5价,得到6个电子变成-1价的Cl-,根据得失电子守恒和电荷守恒,该反应的离子方程式为:6Fe2++6H++ClO3-![]() 6Fe3++Cl-+3H2O。
6Fe3++Cl-+3H2O。


科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是
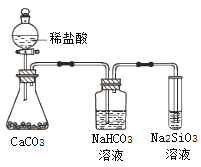
A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中正确的是( )

A. 每个原子都达到8电子稳定结构
B. 键角(Cl—R—Cl)有90°、120°、180°几种
C. RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
D. 分子中5个R—Cl键键能不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组设计如图所示的装置来验证元素非金属性的强弱:
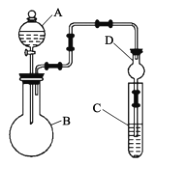
(1)仪器B的名称为___,干燥管D的作用是___。
(2)甲组同学的实验目的:证明非金属性:Cl>I。C中为淀粉—碘化钾混合溶液,B中装有KMnO4固体,则A中试剂为___,观察到C中溶液___(填现象),即可证明。但乙组同学认为该装置有明显的缺陷,改进方案是___。
(3)丙组同学的实验目的:证明非金属性:S>C>Si。在A中加稀硫酸、B中加Na2CO3溶液、C中加Na2SiO3溶液。观察到___(填现象),即可证明。C中发生反应的化学方程式为___。
(4)丁组同学的实验目的:证明非金属性:N>C>Si。实验方案与丙组同学的相似。在A中加稀硝酸、B中加Na2CO3溶液、C中加Na2SiO3溶液。观察到与丙组同学相同的实验现象,即可证明。但丙组同学认为该方案能证明非金属性:N>C,但不能证明非金属性:C>Si,理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低碳经济是指在可持续发展理念指导下,尽可能地减少煤炭、石油等高碳能源消耗,减少温室气体排放,达到经济社会发展与生态环境保护双赢的一种经济发展形态。下列是有关碳元素的相关转化,回答下列问题:
(1)已知甲醇是一种清洁燃料,制备甲醇是煤液化的重要方向。若已知H2(g)、CO(g)、CH3OH(l)的燃烧热分别为H=-285.8kJ/mol、△H=-283.0kJ/mol、△H=-726.5kJ/mol,CO(g)+2H2(g)![]() CH3OH(l) △H=________ kJ/mol。
CH3OH(l) △H=________ kJ/mol。
(2)一定温度下,一定可以提高甲醇合成速率的措施有(______)
a.增大起始通入![]() 值
值
b.恒温恒容,再通入氦气
c.使用新型的高效正催化剂
d.将产生的甲醇及时移走
e.压缩体积,増大压强
(3)在恒温恒容条件下,下列说法可以判定反应CO(g)+2H2(g) ![]() CH3OH(g)已经达到平衡状态的是(______)
CH3OH(g)已经达到平衡状态的是(______)
a.体系中碳氢单键数目不再改变
b.体系中n(CO):n(H2)不再改变
c.体系中压强或者平均摩尔质量不再改变
d.单位时间内消耗氢气和CH3OH的物质的量相等
(4)在恒压的容器中,曲线X、Y、Z分别表示在T1°C、T2°C和T3°C三种温度下合成甲醇气体的过程。控制不同的原料投料比,CO的平衝转化率如图所示:
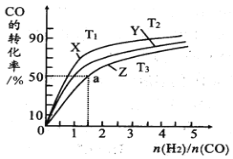
①温度T1°C、T2°C和T3°C由高到低的順序为:_________________;
②若温度为T3°C时,体系压强保持50aMPa,起始反应物投料比n(H2)/n(CO)=1.5,则平衡时CO和CH3OH的分压之比为__________,该反应的压强平衡常数Kp的计算式为__________。(Kp生成物分压幂的乘积与反应物分压幂的乘积的比值,某物质的分压等于总压强×该物质的物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于0.1mol·L-1 Na2CO3溶液的叙述错误的是( )
A.0.5 L该溶液中,Na+的物质的量浓度为0.2mol·L-1
B.1 L该溶液中,含CO32—的数目小于0.1NA(NA是阿伏加德罗常数)
C.从1 L该溶液中取出100 mL,则取出的溶液中Na2CO3的物质的量浓度为0.01mol·L-1
D.取该溶液10 mL,加水稀释至100 mL后,Na2CO3的物质的量浓度为0.01mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最活泼的金属元素、最活泼的非金属元素、常温下呈液态的金属(价电子排布为5d106s2)元素分别位于下面元素周期表中的( )
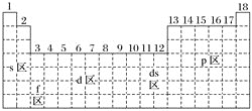
A. s区、p区、ds区 B. s区、p区、d区
C. f区、p区、ds区 D. s区、f区、ds区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C3H7Br的有机物甲在适宜的条件下能发生如下一系列转化:

(1)若B能发生银镜反应,请回答下列问题:
①试确定有机物甲的结构简式:__________________;
②用化学方程式表示下列转化过程:
甲+NaOH![]() ________________________________________________________;
________________________________________________________;
B+Ag(NH3)2OH―→_______________________________________________________。
(2)若B不能发生银镜反应,请回答下列问题:
①试确定A的结构简式:_______________________________________________________。
②用化学方程式表示下列转化过程:
甲+NaOH![]() __________________________________________________;
__________________________________________________;
A―→B:_________________________________________________;
D―→E:___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、W、Q五种短周期元素在周期表中的相对位置如下所示,其中Z原子的核外电子数是其价电子数的3倍,Q的一种核素没有中子。
X | Y | |
Z | W |
请回答下列问题:
(1)元素W在元素周期表中的位置是___________________________;
(2)画出Z的原子结构示意图______________;QXY的电子式为_________________;
(3)Y的最高价氧化物的化学式为_________;
(4)W和Y形成的一种二元化合物具有色温效应,其相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为_________________;
(5) (XY)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com